Категории
Сменить пароль!
Сброс пароля!


Реалии и перспективы применения прокинетика акотиамида в гастроэнтерологии
Маев И.В., Андреев Д.Н.*, Заборовский А.В., Лобанова Е.Г.
ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России
127473, г. Москва, ул. Делегатская, д.20, стр.1, тел. +7 (495) 609-67-00
Маев Игорь Вениаминович – доктор медицинских наук, академик РАН, профессор, заведующий кафедрой пропедевтики внутренних болезней и гастроэнтерологии МГМСУ им. А.И. Евдокимова, заслуженный врач РФ, заслуженный деятель науки РФ.
ORCID: 0000-0001-6114-564X
Андреев Дмитрий Николаевич – кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней и гастроэнтерологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России.
E-mail: [email protected]
ORCID: 0000-0002-4007-7112
Заборовский Андрей Владимирович – доктор медицинских наук, профессор, заведующий кафедрой фармакологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России.
ORCID: 0000-0002-7923-9916
Лобанова Елена Георгиевна – доктор медицинских наук, профессор кафедры фармакологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России.
ORCID: 0000-0002-3426-1843
РЕЗЮМЕ
Акотиамид является прокинетиком принципиально нового механизма действия, являющийся антагонистом мускариновых М1- и М2-рецепторов, а также ингибитором ацетилхолинэстеразы. Блокада М1 и М2 рецепторов на пресинаптической мембране нивелирует тормозное влияние по механизму обратной отрицательной связи на синтез ацетилхолина, тогда как ингибирование ацетилхолинэстеразы в синаптической щели снижает распад данного нейротрансмиттера, который представляет собой основной медиатор тонуса мышечных компонентов ЖКТ, увеличивая его моторную активность. На настоящий момент клиническая эффективность молекулы акотиамида на популяции пациентов с функциональной диспепсией продемонстрирована в более чем 10 клинических исследованиях из разных регионов мира, демонстрирующих регресс симптоматики заболевания на фоне применения данного прокинетика и улучшение качества жизни пациентов. Помимо этого, комбинация акотиамида с ИПП позволяет оптимизировать тактику ведения пациентов с симптомами гастроэзофагеальной рефлюксной болезни.
ВВЕДЕНИЕ
С современных позиций прокинетики — это лекарственные средства, которые усиливают и координируют мышечные сокращения желудочно-кишечного тракта (ЖКТ) [1, 2]. Прокинетики представляют собой химически и фармакологически гетерогенную группу препаратов. При этом основным механизмом их действия считается стимуляция высвобождения ацетилхолина из моторных нейронов межмышечного сплетения [3, 4]. Для реализации этой функции прокинетики могут воздействовать на различные рецепторные компоненты нейрональной связи, регулирующей функцию моторных нейронов межмышечного сплетения. Так, прокинетики могут стимулировать холинергические интернейроны, обладая агонистическим действием по отношению к серотониновым 5-HT4 рецепторам или блокировать ингибирующее воздействие дофаминергических нейронов, обладая антагонистическим действием по отношению к дофаминовым D2 рецепторам [3, 4]. В свою очередь, ацетилхолин, являясь основным медиатором тонуса мышечных компонентов ЖКТ, увеличивает его моторную активность (рис. 1) [3, 5, 6].
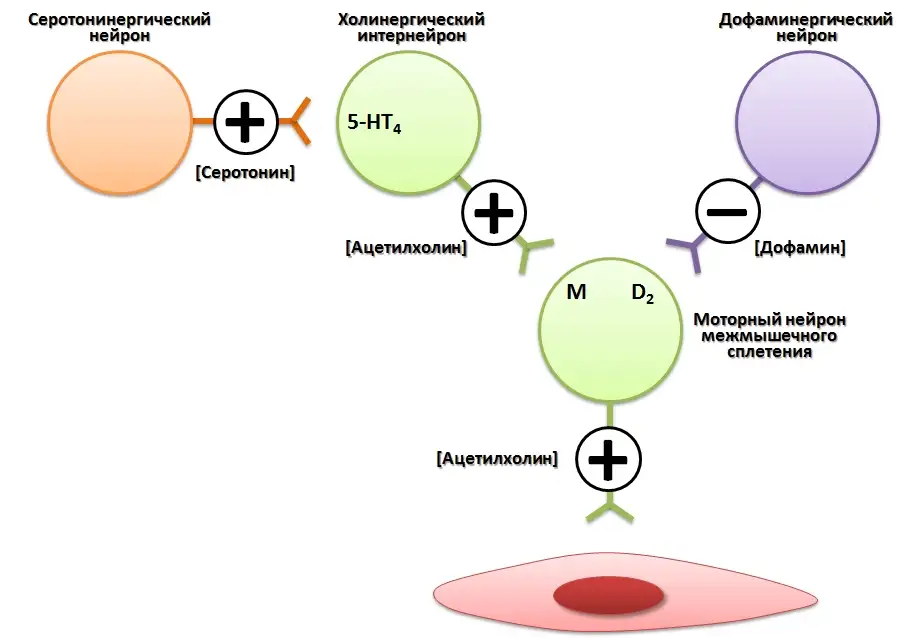
Рисунок 1. Схематическая модель межнейрональных связей, задействованных в регуляции функции моторных нейронов межмышечного сплетения
В современной клинической гастроэнтерологии прокинетики наиболее часто применяются при таких заболеваниях как функциональная диспепсия (ФД) и гастроэзофагеальная рефлюксная болезнь (ГЭРБ) [7]. Эффективность данной группы препаратов у пациентов с ФД подтверждена рядом исследований. В частности, в метаанализе из Кокрановской библиотеки, обобщившем результаты 24 исследований (3178 пациентов), эффективность прокинетиков в лечении ФД составила 57%, что достоверно превышало таковую при приеме плацебо (47%) [8]. Последний метаанализ, опубликованный в 2019 году, включивший 38 исследований, также продемонстрировал эффективность этой группы препаратов в купировании симптомов ФД (ОШ 0,81, 95% ДИ: 0,74–0,89) [9]. В рамках терапии ГЭРБ, показано, что комбинированная терапия с применением ингибиторов протонной помпы (ИПП) и прокинетиков оказывается эффективнее в купировании симптоматики ГЭРБ, чем монотерапия ИПП. В частности, недавний метаанализ Xi L и соавт. (2021 г.), обобщивший результаты 14 исследований (1437 пациентов), продемонстрировал, что добавление прокинетика к ИПП способствует более выраженному регрессу симптоматики заболевания в сравнении с монотерапией ИПП (ОШ 1,185, 95 ДИ: 1,042 - 1,348, р = 0,010) [10].
В России среди препаратов с прокинетическим действием наиболее широкое распространение в настоящий момент получили домперидон и итоприд. Вместе с тем в 2023 году в нашей стране был зарегистрирован прокинетик принципиально нового механизма действия, являющийся антагонистом мускариновых М1 и М2 рецепторов, а также ингибитором ацетилхолинэстеразы (АХЭ), – акотиамид (Диспевикт®, Д-р Редди’с Лабораторис Лтд, Индия).
Целью настоящей обзорной статьи является систематизация данных о фармакологических эффектах и клинической эффективности акотиамида.
ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
С точки зрения механизма действия, акотиамид является антагонистом мускариновых ацетилхолиновых рецепторов (М-рецепторов) типа 1 и 2, а также обратимым ингибитором АХЭ [11 – 14]. Блокада М1 и М2 рецепторов на пресинаптической мембране нивелирует тормозное влияние по механизму обратной отрицательной связи на синтез ацетилхолина, тогда как ингибирование АХЭ в синаптической щели снижает распад данного нейромедиатора (рис. 2).
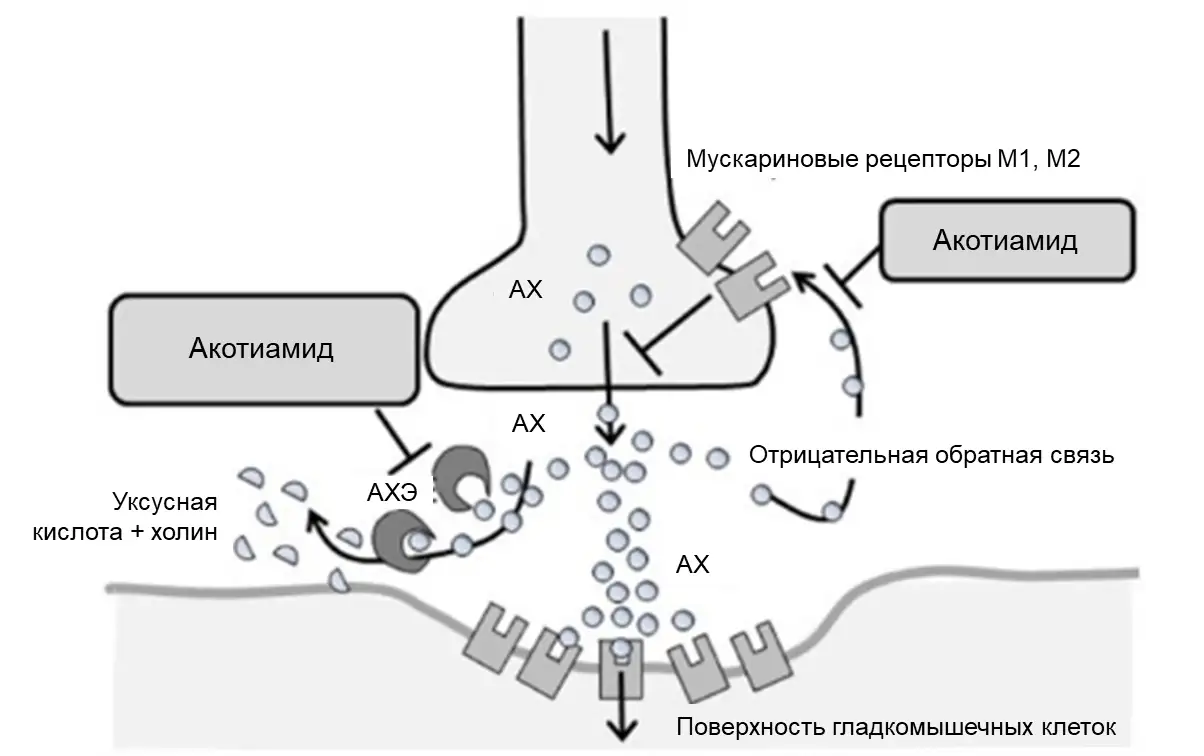
Рисунок 2. Механизм действия акотиамида
Медианная ингибирующая концентрация (median inhibitory concentration, IC50) акотиамида в отношении АХЭ человека составляет 3 мкмоль/л [13]. Константа ингибирования (inhibition constant, Ki) акотиамида в отношении М1- и М2-холинорецепторов человека составляет 27 и 31 мкмоль/л соответственно, что позволяет расценивать участие данного механизма в ослаблении эффектов, обусловленных ингибированием АХЭ [15]. Такой фармакологический профиль акотиамида позволяет ему нормализовать адаптивную релаксацию желудка, улучшить аккомодацию фундального отдела и опорожнение желудка, и уменьшить выраженность симптомов постпрандиального дистресс-синдрома (ПДС) [16].
Акотиамид ингибирует активность АХЭ и М1- и М2-холинорецепторов, что приводит к усилению индуцированного ацетилхолином сокращения и подвижности антрального отдела и тела желудка, тем самым увеличивая постпрандиальную моторику антрального отдела, улучшая моторику антрального отдела и опорожнение желудка при задержке пищи [15]. В доклинических исследованиях in vivo акотиамид стимулировал постпрандиальную моторику в гастродуоденальной области и/или ободочной кишке и ускорял замедленное, но не нормальное опорожнение желудка [17, 18].
Другим важным фармакологическим эффектом акотиамида является его способность повышать уровень грелина в плазме крови [19]. Данное свойство особенно актуально у пациентов с ФД, так как именно нарушение синтеза ацилированного грелина (активная форма молекулы) в организме человека рассматривается как один из механизмов развития данного заболевания [20 – 22].
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ: ФУНКЦИОНАЛЬНАЯ ДИСПЕПСИЯ
Согласно Римским критериям IV пересмотра (2016 г.) под термином ФД понимают наличие одного и более симптомов у пациента – боль или жжение в эпигастрии, чувство переполнения в эпигастрии или ранее насыщение при отсутствии данных об органической (вторичной) патологии, способной объяснить эти симптомы [23, 24]. Выраженность клинических проявлений ФД, а также характерное хроническое течение заболевания, оказывают существенное влияние на качество жизни больных, а также сопряжены с прямыми и косвенными экономическими затратами [25, 26]. Общемировая распространенность истинной ФД среди взрослого населения составляет около 16% (примерно 1,25 млрд человек), но существенно варьирует между популяциями [27]. В Российской Федерации, по данным мультинационального исследования Sperber AD и соавт. (2020 г.), полученным при использовании интернет-опроса респондентов, частота ФД составляет 10,3% (95% ДИ: 9,0 – 11,6) [28].
Эффективность акотиамида в лечении пациентов с ФД была неоднократно показана в клинических исследованиях. Так, еще в раннем метаанализе Xiao et al. (2014) продемонстрировано, что у пациентов, принимавших акотиамид, суммарный относительный риск (ОР) для общего уменьшения выраженности симптомов ФД составил 1,29 (95% ДИ, 1,19–1,40, p < 0,00001; 𝐼2 = 15%) по сравнению с показателем у пациентов, принимавших плацебо. После приема акотиамида наблюдали уменьшение выраженности симптомов у пациентов с постпрандиальным дистресс-синдромом (ПДС) (ОР 1,29; 95% ДИ 1,09–1,53, p = 0,003; 𝐼2 = 0%). Суммарный ОР у пациентов с ЭПС составил 0,92 (95% ДИ, 0,76–1,11, p = 0,39; 𝐼2 = 0%). Прием акотиамида в дозе 100 мг 3 раза в день был также эффективен в отношении устранения отдельных симптомов у пациентов с ФД, по сравнению с пациентами, принимавшими плацебо. Таким образом, прием акотиамида перорально в дозе 100 мг 3 раза в день приводит к уменьшению тяжести симптомов у пациентов с ФД, особенно у пациентов с ПДС и может быть надежным методом лечения ФД [29].
На настоящий момент клиническая эффективность молекулы акотиамида на популяции пациентов с ФД продемонстрирована в 11 клинических исследованиях из разных регионов мира, демонстрирующих регресс симптоматики заболевания на фоне применения данного прокинетика и улучшение качества жизни (табл. 1).
Таблица 1. Обзор клинических исследований по применению акотиамида у пациентов с ФД
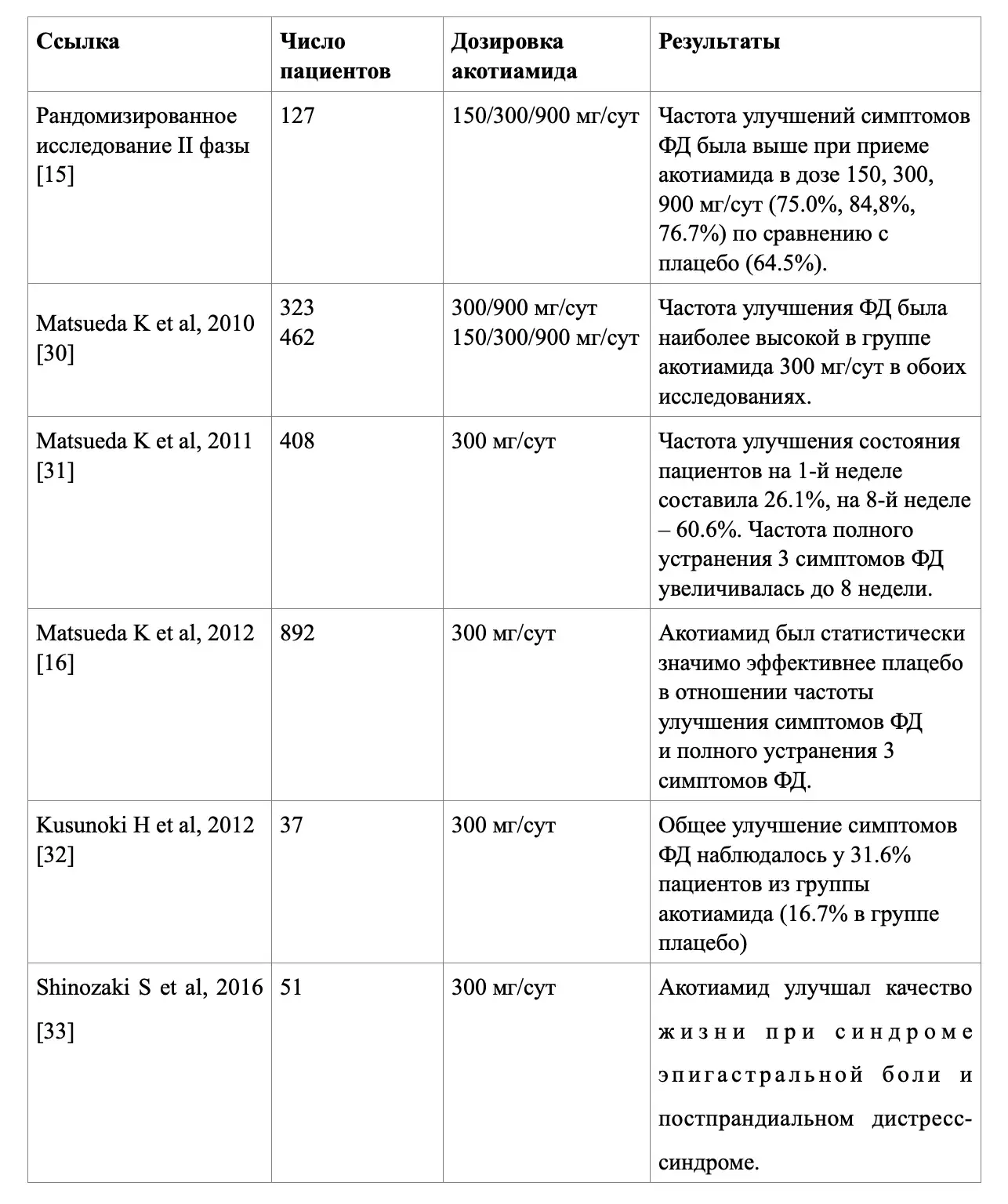
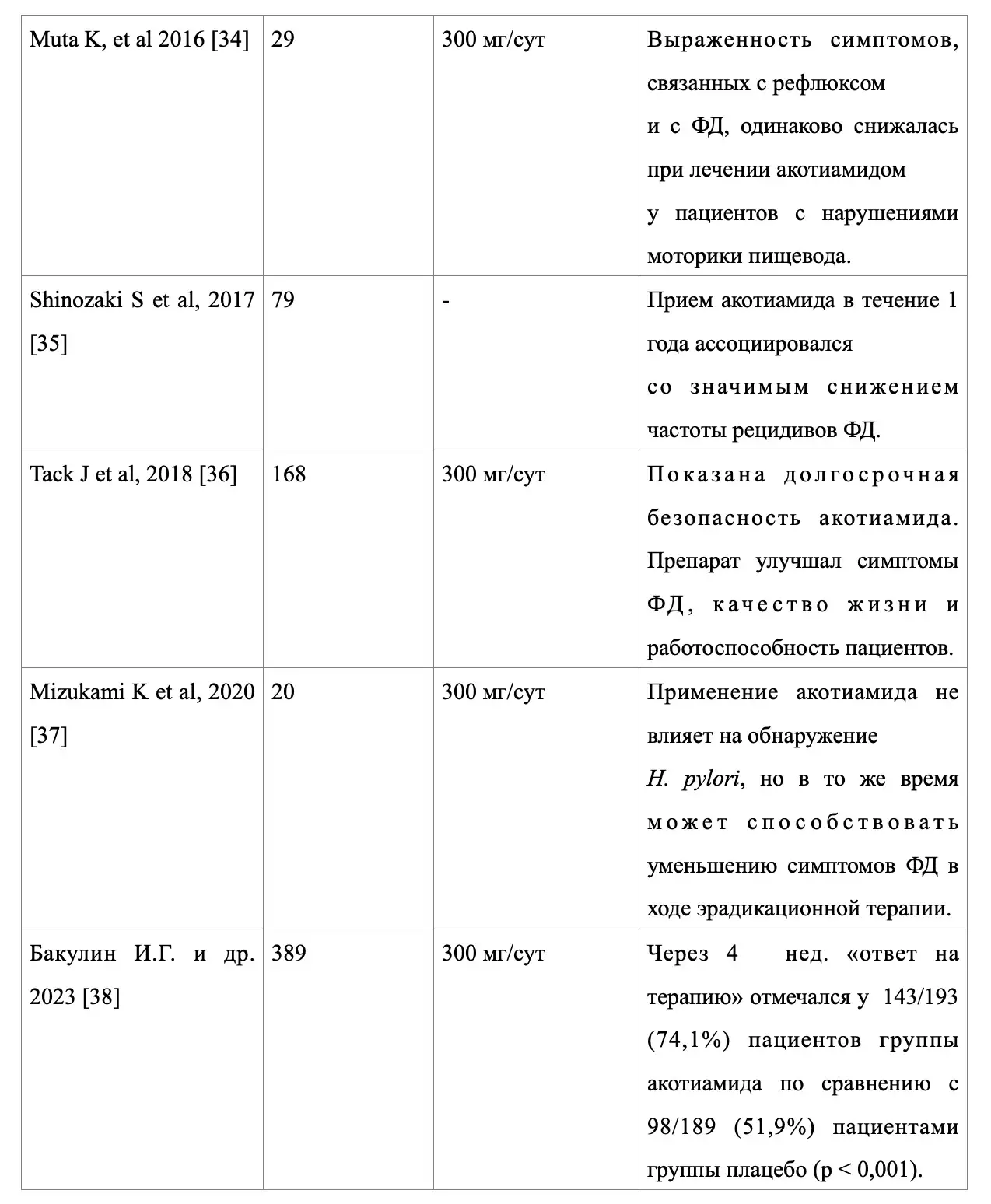
Отдельно хотелось бы представить результаты первой российской работы по данному направлению рандомизированного дизайна, выполненной Бакулиным И.Г. и соавт. (2023), на популяции 389 пациентов [38]. Данное исследование продемонстрировало, что через 4 недели «ответ на терапию» (по 7-балльной шкале Лайкерта) отмечался у 143/193 (74,1%) пациентов группы акотиамида по сравнению с 98/189 (51,9%) пациентами группы плацебо (p<0,001). На фоне терапии акотиамидом, в отличие от плацебо, наблюдалась полная редукция и облегчение некоторых симптомов ФД с ПДС, а именно: «причиняющее беспокойство ощущение переполнения после приема обычного объёма пищи, влияющее на повседневную активность», «причиняющее беспокойство ощущение раннего насыщения (включая неспособность съесть обычный объём пищи)» и «постпрандиальное вздутие в области эпигастрия». Также после применения акотиамида отмечалось улучшение клинического состояния и качества жизни у 172/194 (88,7%) пациентов по сравнению с 131/189 (69,3%) пациентов группы плацебо (p<0,001). Частота развития нежелательных явлений в группе акотиамида не отличалась от частоты в группе плацебо [38].
Стоит отметить, что, учитывая значимую доказательную базу эффективности акотиамида у пациентов с ФД, данный препарат включен в последние клинические рекомендации Японского общества гастроэнтерологов (2021): «для первой линии терапии ФД рекомендовано применение ингибитора ацетилхолинэстеразы акотиамида [сильная рекомендация (100%), уровень доказательности А]» [39]. Помимо этого, акотиамид отмечен в числе прокинетиков, которые могут быть эффективны в качестве первой линии терапии ФД, в последних рекомендациях Британского общества гастроэнтерологов (2022) [40].
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ: ГАСТРОЭЗОФАГЕАЛЬНАЯ РЕФЛЮКСНАЯ БОЛЕЗНЬ
ГЭРБ — это хроническое рецидивирующее заболевание, обусловленное нарушением моторно-эвакуаторной функции органов гастроэзофагеальной зоны и характеризующееся регулярно повторяющимся забросом в пищевод желудочного и в ряде случаев дуоденального содержимого, повреждающего слизистую оболочку дистального отдела пищевода, а также индуцирующего клиническую симптоматику заболевания (изжога и регургитация) [41, 42]. Выраженная полиморфность клинических проявлений ГЭРБ, а также характерное хроническое течение, оказывают существенное негативное влияние на качество жизни больных [43, 44]. Согласно последнему метаанализу Nirwan JS и соавт. (2020 г.), обобщившему результаты 102 исследований, глобальная распространенность ГЭРБ составляет 13,98% (95% ДИ: 12,47 – 15,56%) [45]. Недавно опубликованное многоцентровое исследование распространенности симптомов ГЭРБ у пациентов поликлиник в России с использованием опросника клиники Мэйо показало, что в крупной выборке респондентов (n = 6132) частота заболевания составила 34,2% [46].
На сегодняшний день в ряде исследований установлена эффективность комбинированной терапии ИПП и прокинетиками у пациентов с ГЭРБ, особенно в случае рефрактерной симптоматики заболевания [10, 47 – 49]. В случае с акотиамидом также несколько работ свидетельствуют о повышении эффективности регресса симптоматики ГЭРБ при использовании комбинации с ИПП. В частности, наиболее показательным является рандомизированное двойное слепое плацебо-контролируемое исследование Yamashita et al. (2019), в рамках которого сравнили эффективность применения комбинированной терапии ИПП и акотиамидом у пациентов с ГЭРБ [50]. В исследовании участвовали 70 пациентов с доказанной ГЭРБ (всем пациентам выполняли фиброгастродуоденоскопию), которых случайным образом разделили на группы лечения: в первой группе больные (n = 35) получали комбинированную терапию акотиамидом в дозе 300 мг/сут и ИПП в течение 2 недель, во второй группе (n = 35) – монотерапию ИПП в течение 2 недель. Через 2 недели исследования у 28,6% пациентов из группы комбинированного применения акотиамида и ИПП отметили снижение тяжести клинических симптомов, которое было статистически незначимо выраженнее, чем у больных из группы монотерапии ИПП – 14,3% пациентов (p = 0,145). Однако, в субпопуляции пациентов с неэрозивной ГЭРБ (n = 55), количество пациентов со снижением выраженности клинических симптомов в группе комбинированного применения составило 29,6%, что было статистически значимо больше, чем в группе применения монотерапии ИПП – 7,1% (p = 0,03) [50].
ЗАКЛЮЧЕНИЕ
Таким образом, акотиамид является прокинетиком принципиально нового механизма действия, являющийся антагонистом мускариновых М1- и М2-рецепторов, а также ингибитором ацетилхолинэстеразы. Блокада М1 и М2 рецепторов на пресинаптической мембране нивелирует тормозное влияние по механизму обратной отрицательной связи на синтез ацетилхолина, тогда как ингибирование ацетилхолинэстеразы в синаптической щели снижает распад данного нейротрансмиттера, который представляет собой основной медиатор тонуса мышечных компонентов ЖКТ, увеличивая его моторную активность. На настоящий момент клиническая эффективность молекулы акотиамида на популяции пациентов с функциональной диспепсией продемонстрирована в более чем 10 клинических исследованиях из разных регионов мира, демонстрирующих регресс симптоматики заболевания на фоне применения данного прокинетика и улучшение качества жизни пациентов. Помимо этого, комбинация акотиамида с ИПП позволяет оптимизировать тактику ведения пациентов с симптомами гастроэзофагеальной рефлюксной болезни.
Литература
Статья д.м.н., академика РАН, профессора Игоря Вениаминовича Маева, посвященную реалиям и перспективам применения нового прокинетика акотиамида.
Почему его механизм действия называют принципиально новым? Что показали исследования среди пациентов с функциональной диспепсией? На какие сопутствующие заболевания ЖКТ он также может влиять?
Комментарии (0)