Категории
Сменить пароль!
Сброс пароля!


На сегодняшний день уже миллионы людей по всему миру переболели COVID-19.
Эффективность вакцины ZyCoV-D против COVID-19 при внутрикожном введении составила 66,6 %.
На сегодняшний день уже миллионы людей по всему миру переболели COVID-19. Пациенты с коронавирусной инфекцией (в основном в возрасте до 60 лет), а также пациенты с уже имеющимися заболеваниями органов дыхания или сердечно-сосудистыми заболеваниями подвергаются более высокому риску развития серьезных осложнений и смерти. Распространение COVID-19 привело к повышению уровня смертности и спаду национальной экономики. До тех пор, пока большая часть мирового населения не будет вакцинирована, остается риск повышения уровня заболеваемости COVID-19 и негативного влияния этого вируса на социальную и экономическую жизнь.
Уже зарегистрирован ряд вакцин против коронавируса, но их все еще недостаточно для борьбы с пандемией. Именно поэтому необходимо обеспечить производство вакцин в больших масштабах, их широкое применение на местном уровне, распространение по всему миру и приемлемую стоимость. Эффективного распределения вакцин по странам можно достичь, разработав устойчивые к воздействию температур препараты: в таком случае соблюдение холодовой цепи не потребуется. Появление ДНК-вакцины ZyCoV-D позволяет преодолеть трудности производства и транспортировки РНК-вакцин.
Ключевой характеристикой вакцины ZyCoV-D является стабильность при воздействии температур. Вакцину хранили при температуре 2–8 °C, но при хранении при комнатной температуре (25 °C) она сохраняла стабильность в течение не менее 3 месяцев. Это соответствует всем критериям приемлемости, установленным Управлением по контролю качества пищевых продуктов и лекарственных средств США, а также в международных руководствах. Результаты исследования стабильности вакцины в открытых флаконах свидетельствуют о стерильности и стабильности вакцины ZyCoV-D в течение 28 дней. Это позволяет сократить потери вакцины, так как не нужно ждать, пока наберется группа из нескольких человек на введение вакцины из одного флакона.
Согласно результатам адаптивного исследования I/II фазы по оценке применения вакцины ZyCoV-D у здоровых добровольцев, 43 пациента из 48 завершили исследование I фазы продолжительностью 84 дня, а 911 пациентов из 1000 — исследование II фазы продолжительностью 224 дня. О развитии проблем по безопасности при введении вакцины ZyCov-D в дозе до 2 мг путем игольной или безыгольной инъекции не сообщалось. Вакцинация способствовала развитию достаточного иммунного и выраженного клеточного ответа. Кроме того, вакцина имела благоприятный профиль переносимости и безопасности.
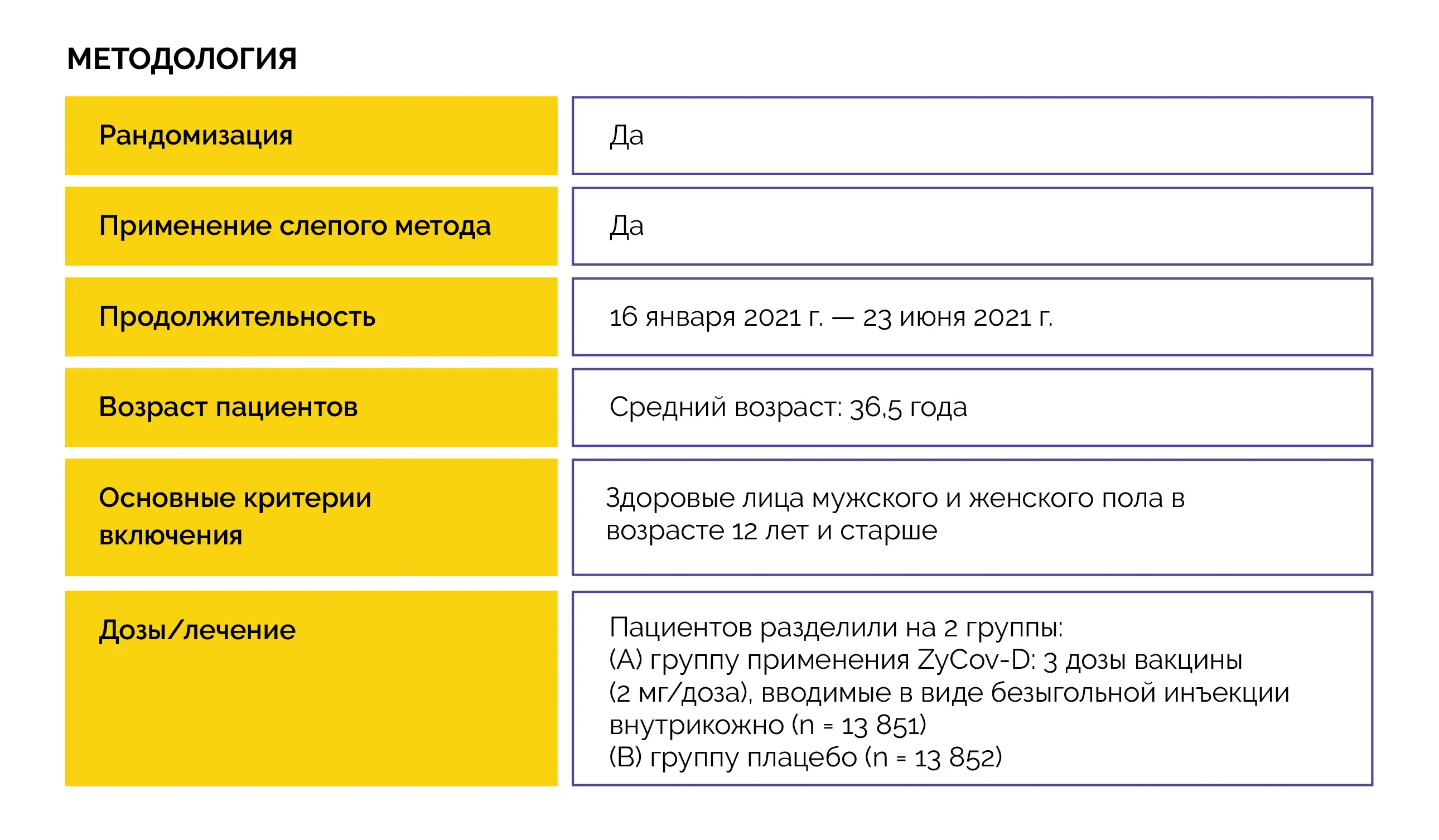
ОБОСНОВАНИЕ ИССЛЕДОВАНИЯ
Ни в одном из ранее проведенных исследований не оценивали эффективность вакцины на основе плазмидной ДНК против COVID-19. Поэтому было проведено это рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование III фазы.
ЦЕЛЬ
Проведен промежуточный анализ для комплексной оценки эффективности, безопасности и иммуногенности вакцины ZyCov-D против COVID-19.

Конечные точки исследования
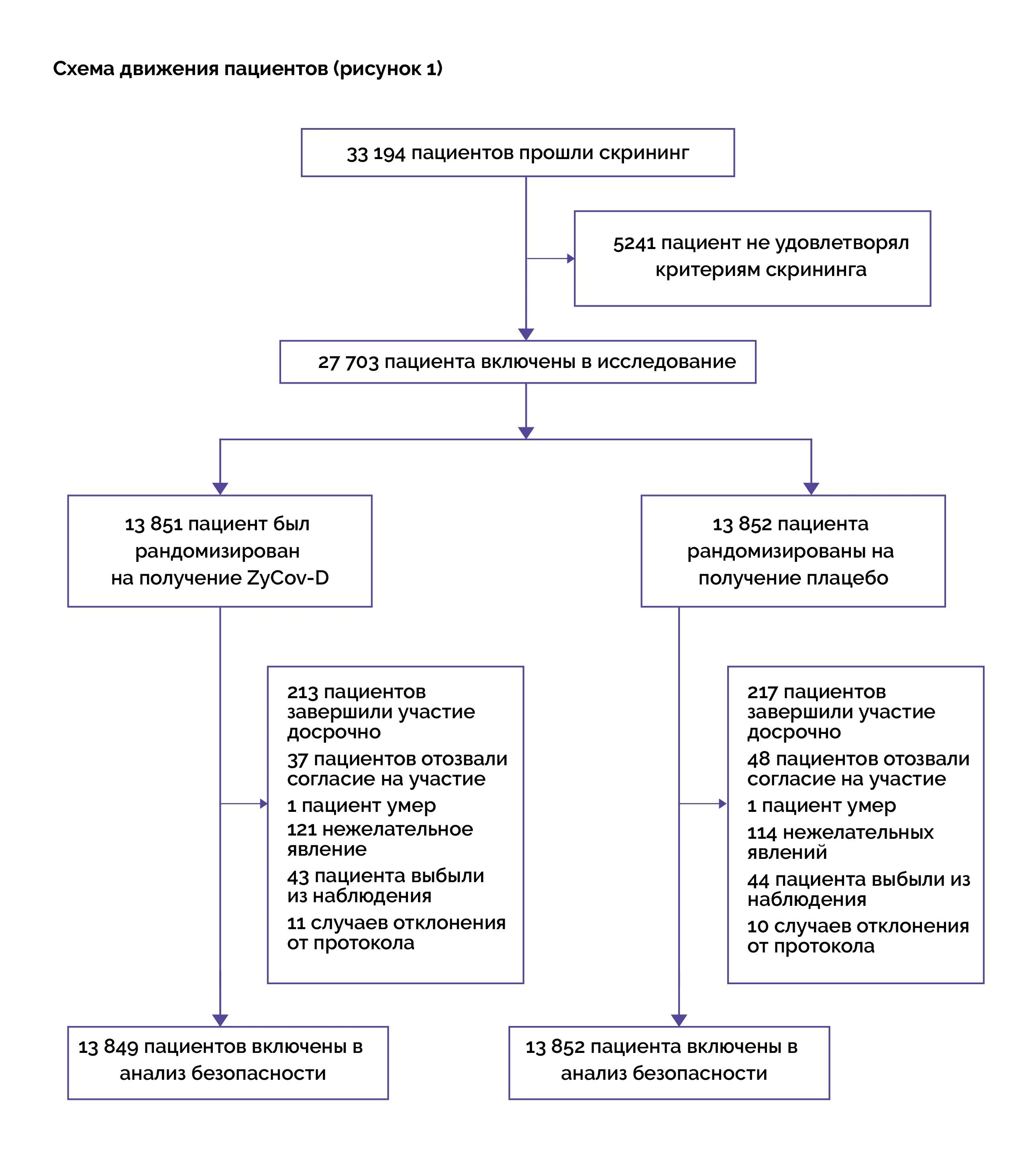
Результаты
Исходный уровень: на исходном уровне статистически значимых различий между группами не выявлено.
Конечные точки исследования
С учетом профиля эффективности и безопасности, полученного в исследовании I/II фазы, результаты клинического исследования III фазы свидетельствуют об эффективности, безопасности и иммуногенности ДНК-вакцины ZyCoV-D для профилактики COVID-19. Эффективность вакцины против COVID-19 при введении по трехдозной схеме внутрикожно с помощью безыгольной системы составила 66,6 %. Исследование проводили во время второй волны коронавирусной инфекции, которая главным образом была вызвана вирусом штамма B.1.617.2 (дельта).
В конце апреля 2021 г. наблюдался быстрый рост доли пациентов, инфицированных вирусом штамма дельта. Вакцина ZyCoV-D эффективна против вируса штамма дельта. В группе применения ZyCoV-D не зарегистрировано ни одного случая коронавирусной инфекции средней или тяжелой степени. Следовательно, в профилактике COVID-19 средней и тяжелой степени вакцина была признана эффективной на 100 %, и на 64,9 % — в профилактике легкой степени заболевания. Таким образом, при полной вакцинации с использованием вакцины ZyCoV-D можно было бы значительно сократить число случаев COVID-19 средней и тяжелой степени.
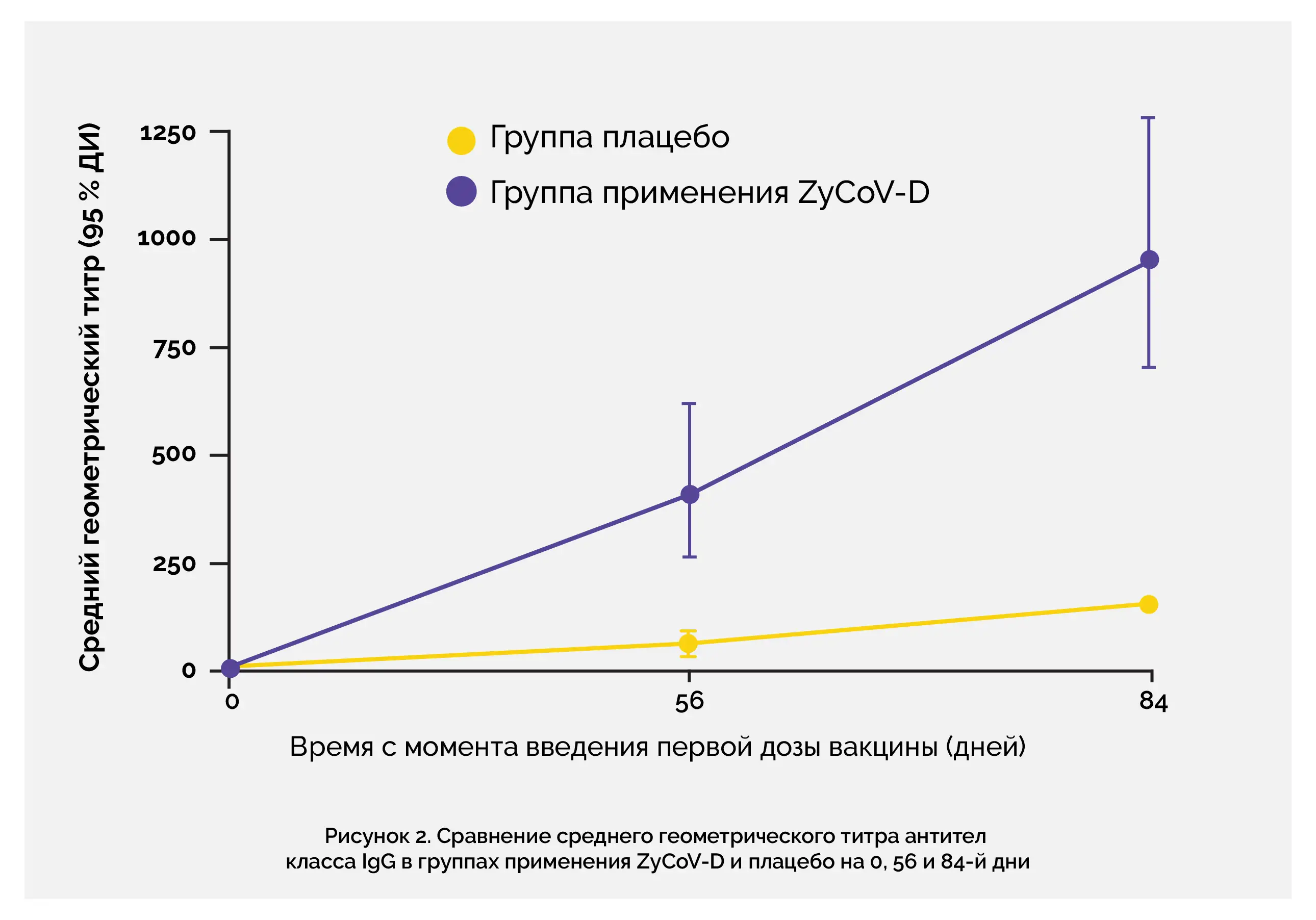
В исследовании III фазы иммуногенность ZyCoV-D, наблюдаемая в исследовании I/II фазы, сохранялась. Вакцина ZyCoV-D индуцировала выраженный иммунный ответ на 84-й день, оцениваемый по уровню сероконверсии (93,33 %) на основании определения антител класса IgG к домену S1 белка (методом ИФА), СГТ (952,67 ИФА ед, 95 % ДИ: 707,94–1282,00), фактору сероконверсии (136,09, 95 % ДИ: 101,11–183,1), титру нейтрализующих антител (СГТ: 133,39, методом реакции нейтрализации бляшкообразования (PRNT50), 95 % ДИ: 86,88–204,81; фактор сероконверсии: 26,68, 95 % ДИ: 17,38–40,96). Вакцинация способствовала развитию выраженного клеточного ответа, о чем свидетельствовал повышенный уровень интерферона-γ в группе применения ZyCoV-D по сравнению с группой плацебо.
Благоприятный профиль безопасности ZyCoV-D был подтвержден в ходе промежуточного анализа данных исследования III фазы, что согласовалось с результатами исследования I/II фазы. Результаты свидетельствуют о том, что профиль переносимости ZyCoV-D у пациентов с сопутствующими заболеваниями, пациентов старше 60 лет и пациентов в возрасте 12–17 лет сопоставим с профилем в общей популяции исследования. Случаев развития серьезной токсичности не отмечалось. Основные побочные эффекты были легкой или умеренной степени тяжести и разрешились. Наиболее частыми местными побочными эффектами были зуд, отек, покраснение и боль в месте введения,
а наиболее частыми системными побочными эффектами — утомляемость, мышечная боль, повышенная температура тела и головная боль. Эти системные и местные побочные эффекты после введения вакцины ZyCoV-D были аналогичны явлениям, наблюдаемым в группе плацебо, что указывает на отсутствие повышенного риска развития побочных эффектов при применении вакцины. Степень тяжести и тип наблюдаемых побочных эффектов согласовывались с таковыми в исследовании II фазы другой ДНК-вакцины.
Введение вакцины с помощью безыгольной системы должно привести к уменьшению частоты развития побочных эффектов, связанных с использованием иглы, таких как боль в месте введения. Вакцину следует хранить при температуре 2–8 °C, но при хранении при комнатной температуре (25 °C) она сохраняет стабильность в течение не менее 3 месяцев. Это соответствует критериям приемлемости, установленным Управлением по контролю качества пищевых продуктов и лекарственных средств США, а также в международных руководствах. Стабильность вакцины при воздействии температур облегчает ее хранение и транспортировку и предупреждает потери за счет отсутствие необходимости соблюдения холодовой цепи.
Платформа плазмидной ДНК обеспечивает простоту производства при минимальных требованиях к биологической безопасности. Поскольку ZyCoV-D представляет собой вакцину на основе плазмидной ДНК, она не вызывает проблем, связанных с развитием иммунного ответа, наблюдаемых при использовании векторных вакцин (например, недостаточный иммунный ответ на целевые антигены после вакцинации из-за уже имеющихся антител к векторам в результате естественного инфицирования вирусами гриппа, кори или аденовирусами).
Другие проблемы, связанные с применением векторных вакцин, включают необходимость введения очень высоких доз, приводящих к развитию многочисленных побочных эффектов, и необходимость увеличения интервала между бустерными дозами для снижения влияния вектора на развитие иммунного ответа. Платформа плазмидной ДНК позволяет быстро создавать новые структуры с учетом мутаций вируса. Трехдозная схема введения соответствует третьей бустерной дозе.
ДНК-вакцина против COVID-19 для внутрикожного введения (ZyCoV-D) является эффективной, безопасной и иммуногенной. Она пригодна для профилактики коронавирусной инфекции в большой популяции, а ее производство является обоснованным и экономически целесообразным.
Эта вакцина может стать перспективным методом борьбы с пандемией COVID-19.
Lancet
Efficacy, safety, and immunogenicity of the DNA SARS-CoV-2 vaccine (ZyCoV_D): the interim efficacy results of a phase 3, randomised, double-blind, placebo-controlled study in India
Akash Khobragade и соавт.
Комментарии (1)