Категории
Сменить пароль!
Сброс пароля!


Представляем вашему вниманию статью «Остеоартроз фасеточных и реберно-поперечных суставов позвоночника как причина хронической боли в грудном отделе позвоночника»
Остеоартроз — одна из наиболее частых причин снижения трудоспособности и уровня качества жизни. Патология фасеточных суставов и реберно-поперечных сочленений рассматривается как одна из основных причин хронической боли в грудной клетке и грудном отделе позвоночника. Представлен собственный опыт диагностики и лечения 52 пациентов с хроническим болевым синдромом в грудном отделе позвоночника в возрасте от 30 до 68 лет.
Представляем вашему вниманию статью «Остеоартроз фасеточных и реберно-поперечных суставов позвоночника как причина хронической боли в грудном отделе позвоночника»
Остеоартроз — одна из наиболее частых причин снижения трудоспособности и уровня качества жизни. Патология фасеточных суставов и реберно-поперечных сочленений рассматривается как одна из основных причин хронической боли в грудной клетке и грудном отделе позвоночника. Представлен собственный опыт диагностики и лечения 52 пациентов с хроническим болевым синдромом в грудном отделе позвоночника в возрасте от 30 до 68 лет.
Боль в груди является одним из наиболее распространенных симптомов, требующих медицинской помощи в амбулаторных условиях. Патология сердечно-сосудистой и дыхательной систем обычно находится в центре внимания при первоначальной диагностической оценке. После ее исключения в дифференциальную диагностику добавляют другие состояния, влияющие на структуры в грудной клетке и вокруг нее, в том числе заболевания пищевода, верхней части живота, головы, шеи и грудной стенки [1].
Доля пациентов с болью в груди, имеющей скелетно-мышечный источник, варьирует в зависимости от клинических условий, достигая четверти в условиях неотложной помощи и более трети в амбулаторных клиниках, не связанных с неотложной помощью [2].
Причины и дифференциальная диагностика боли в груди
Демографические особенности пациента, характеристика боли в груди и связанные с ними симптомы могут способствовать диагностике боли в груди со стороны опорно-двигательного аппарата или указывать на другие причины болевого синдрома и дискомфорта в груди [3]. Важные особенности анамнеза при боли в груди:
Болевые синдромы передней грудной стенки
Существует ряд синдромов передней грудной стенки, характеризующихся болью в груди, связанной с местной или регионарной болезненностью, таких как костостернальные или костохондральные болевые синдромы, которые возникают из-за воспаления опорно-двигательного аппарата, чрезмерного кашля или спортивных травм.
Костостернальные синдромы (костохондрит)
У большинства пациентов с синдромами опорно-двигательного аппарата грудной стенки наблюдается более диффузный, но обычно регионарный болевой синдром, при котором обнаруживаются множественные области болезненности, пальпация которых воспроизводит типичный паттерн боли. Наиболее часто поражаются верхние реберные хрящи в костохондральных или костостернальных соединениях [5]. Области болезненности не сопровождаются жаром, эритемой или локализованным отеком [6].
У этой группы пациентов использовались различные диагностические термины, включая «костохондрит», «костостернальный синдром» и «синдром передней грудной стенки». Диагноз основан исключительно на способности воспроизводить боль при пальпации болезненных участков. В исследовании S. Bösner et al. [5] с участием 1212 амбулаторных пациентов было показано, что следующие симптомы были положительно ассоциированы с синдромом боли передней грудной стенки: локализованное мышечное напряжение, покалывающая боль, воспроизведение боли при пальпации.
Хотя костостернальный синдром является частым диагнозом у пациентов с некардиальной болью в груди, причины, анамнез и лечение этого состояния недостаточно изучены и нам не удалось найти опубликованные результаты рандомизированных двойных слепых плацебо-контролируемых клинических исследований (РКИ) данной патологии. Большинство проспективных исследований показывают, что около половины этих пациентов будут продолжать испытывать боль в груди в течение 6–12 мес. при умеренном ограничении активности [7].
Синдром Титце
Синдром Титце определен как доброкачественный, болезненный, не поддерживающий локализованный отек реберных, грудино-ключичных или костохондральных суставов, чаще всего затрагивающий область второго и третьего ребер [8]. Обычно затрагивается только одна область, и чаще всего страдают молодые люди. Взаимосвязь между синдромом Титце и поражением передней грудной стенки спондилоартритами и грудино-ключичным гиперостозом является неопределенной, но некоторые эксперты ставят под сомнение существование синдрома Титце как отдельной нозологии [9].
Синдром Титце встречается редко, и его следует отличать от более диффузных форм миофасциальной боли в груди (костохондрита), при которых при осмотре не обнаруживается областей локализованного отека. Причина синдрома Титце неизвестна, но у некоторых пациентов были описаны предшествующие инфекции верхних дыхательных путей и чрезмерный кашель. Спонтанное выздоровление при синдроме Титце наступает только у 3–5% пациентов. Без соответствующего лечения заболевание принимает хроническое ремиттирующее течение. При надлежащем противовоспалительном лечении, устранении факторов воздействия процесс в ребрах прекращается, однако произошедшие реберные деформации уже необратимы [10].
Манубрит
Манубрит — редко описываемое состояние, при котором локализованная болезненность обнаруживается непосредственно над телом грудины или вышележащей грудинной мышцей, и пальпация часто вызывает двустороннюю боль. Этот синдром, как правило, самоограничен и с меньшей вероятностью вызывает постоянную боль, чем более диффузный костостернальный синдром. Могут быть заметны рентгенографические изменения или повышенное поглощение при сканировании костей.
Ксифоидит
Ксифоидит (ксифоидалгия, ксифодиния) является еще одним относительно редким синдромом, который характеризуется локализованным дискомфортом и болезненностью в области мечевидного отростка грудины [11]. Симптомы часто усугубляются при употреблении тяжелой пищи или сгибательных либо скручивающих движениях, симптомы также могут быть связаны с возобновлением тяжелой работы или недавним кашлем, что указывает на травматическую причину у некоторых пациентов.
Акромиально-ключичный артрит
Акромиально-ключичный артрит преимущественно возникает после травмы верхнего плечевого пояса. Спустя продолжительное время после травмы реактивное воспаление приводит к дегенерации хряща и появлению деформаций. Артрит акромиально-ключичного сустава проявляется следующими симптомами: местная локальная болезненность у наружного края ключицы; боль при размашистых, широких движениях в плечевом поясе; болезненность при скрещивании рук на груди; прострелы из грудины по ходу руки; изменение формы акромиально-ключичного сочленения.
Грудино-ключичный сустав, фиксирующий верхний плечевой пояс к грудной клетке, редко поражается изолированно от других структур. Чаще наблюдается сочетанная патология, связанная со спортивными или профессиональными перегрузками и травмами. Клинические особенности: боль в верхней части грудной клетки, усиливающаяся при подъеме тяжести, глубоком вдохе; боль при пальпации и крепитация при движении в проекции грудино-ключичного сочленения, проксимальный конец ключицы деформируется, что нередко обнаруживается при визуальном осмотре.
Верхние пары ребер прикрепляются к грудине посредством реберно-грудинных сочленений, которые также могут подвергаться дегенеративному процессу. Артрит реберно-грудинных сочленений имеет следующие проявления: боль в грудине при глубоком вдохе; локальная болезненность при пальпации реберно-грудинного сочленения; прострелы по ходу ребер, имитирующие межреберную невралгию; деформация грудины и непосредственно реберно-грудинного сустава.
Болевые синдромы задней грудной стенки
Болевые синдромы грудного отдела позвоночника чаще встречаются у работников тяжелого физического труда. Боль в межлопаточной области может сочетаться с болью в передней грудной стенке [2]. Существует несколько причин боли в задней стенке грудной клетки.
Диско-радикулярный конфликт на грудном уровне встречается исключительно редко и связан с деструктивными процессами в грудных позвонках, но его следует учитывать у пациентов с односторонней дерматомной болью и неврологической дефицитарной симптоматикой по радикулярному типу [12].
Дисфункция костовертебрального сустава — еще одно необычное состояние, вызывающее боль в задней стенке грудной клетки. Пациенты, как правило, испытывают боль, которая усиливается при кашле или глубоком дыхании, и часто проходят обследование на наличие внутрилегочного процесса [13]. При физическом осмотре боль часто воспроизводится при пальпации в области реберно-позвоночных сочленений или непосредственно над пораженным ребром, а локальная гиперальгезия может быть вызвана защемлением кожи. В некоторых случаях в пораженных суставах наблюдаются дегенеративные изменения.
Фасеточный синдром нередко появляется при резких неподготовленных движениях, связанных с вращением туловища, подъеме и ношении тяжестей (чаще именно спереди), длительном фиксированном положении, работе с поднятыми над головой руками. Патогенез синдрома связан с перегрузкой дугоотростчатых (фасеточных) суставов и их блокированием на фоне увеличения нагрузки на сустав и его связочный аппарат. Выраженность боли, связанной с фасеточным синдромом, может варьировать от легкой до достаточно интенсивной, приводя к обездвиженности в грудном отделе позвоночника. Нередко боль локализуется в межлопаточной области, усиливается при разгибании и уменьшается при сгибании позвоночника и может распространяться на переднюю поверхность грудной клетки. Ниже и выше уровня блокирования сустава довольно часто определяется рефлекторный спазм мышцы, выпрямляющей позвоночник. Боль провоцируется при глубокой пальпации соответствующего дугоотростчатого сустава [14–16]. Во время пальпации пораженного сустава нередко воспроизводится феномен «пружинирования» — кратковременное локальное повышение тонуса паравертебральных мышц в проекции сустава, ощущаемое пальпаторно как срабатывание сжатой пружины (см. ниже).
Ключевыми для биомеханики грудной клетки являются суставы плечевого пояса — грудино-ключичный и акромиально-ключичный. Поражение этих суставов нередко затрагивает верхние реберно-грудинные сочленения. В настоящее время механизмы развития остеоартрита грудино-ключичного и акромиально-ключичного суставов не изучены до конца. Наблюдаются такие патоморфологические изменения, как: снижение плотности костей, образующих сочленение; дегенеративно-дистрофические изменения внутрисуставного хряща; вялотекущий воспалительный процесс в синовиальной полости.
В ответ на подобные изменения в костной ткани образуются компенсаторные механизмы пролиферации, что способствует образованию костных выростов — остеофитов и нарушению конгруэнтности суставных поверхностей, усугубляющему течение заболевания [17]. Клинически болезнь проявляется в зависимости от вовлечения того или иного сустава, однако имеется общая характеристика симптомов: боль возникает и усиливается при нагрузке и к концу дня; утренняя скованность не характерна и длится недолго; боль беспокоит только в начале движения; имеется ограничение подвижности в том или ином суставе. При нейроортопедическом исследовании на патологию конкретных фасеточных суставов и реберно-поперечных сочленений может указывать тест «пружинирования»: при пальпации пораженного сустава пациент лежит на животе поперек кушетки, руки вдоль туловища, бедра свешиваются вниз — определяется локальная болезненность и ощущается эффект пружины под пальцем по мере усиления давления за счет защитного напряжения паравертебральных мышц.
Для лечения пациентов с вышеописанными фенотипами скелетно-мышечной боли в грудной клетке ввиду отсутствия РКИ и клинических рекомендаций используется эмпирический подход, основанный на лечении симптомов боли НПВС и мышечного спазма миорелаксантами. Мультидисциплинарный диагностический поиск для исключения угрожающих жизни заболеваний и висцеральной патологии является основой ведения таких больных.
Собственный опыт ведения пациентов с хронической болью в грудном отделе позвоночника
Приводим собственный опыт применения мультидисциплинарного подхода в лечении пациентов с хронической неспецифической болью в грудном отделе позвоночника. Нами наблюдались 52 пациента с хронической болью в грудном отделе позвоночника в возрасте от 30 до 68 лет (средний возраст 49±19 лет): 20 (38,5%) мужчин и 32 (61,5%) женщины.
Выявление болевого триггера при первичной консультации основывалось на результатах анализа жалоб, анамнеза, исследования неврологического и нейроортопедического статуса. Интенсивность болевого синдрома оценивалась по цифровой рейтинговой шкале (ЦРШ), где 0 баллов — отсутствие боли, а 10 баллов — максимально интенсивная невыносимая боль, степень нарушения жизнедеятельности — по опроснику Освестри и шкале SF-12. Нейроортопедическое тестирование включало стандартный набор тестов, а также дополнительные маневры для воспроизведения боли в грудной стенке, по результатам которых пациентов разделили на группы по предполагаемому источнику ноцицептивной импульсации: фасеточный синдром (ФС), синдром передней грудной клетки (СПГК), миофасциальный болевой синдром (МФБС) и их сочетания.
Выполняются следующие маневры [6]. В грудном отделе позвоночника болезненность при пальпации или усилении боли при движении могут свидетельствовать о скелетно-мышечной причине боли [6]. Движение сочленений ребер с грудными позвонками (костовертебральные суставы) следует оценивать путем измерения расширения грудной клетки. Расширение грудной клетки измеряется на уровне четвертого межреберного промежутка или чуть ниже соска у женщин. Пациенту предписывается сделать максимальный форсированный выдох, за которым следует максимальный вдох. Расширение обычно составляет 5 см или более; расширение менее 2,5 см является ненормальным. У пациентов с подозрением на скелетно-мышечную боль в груди следует пальпировать множественные участки мягких тканей и суставов, особенно у пациентов с распространенной скелетно-мышечной болью в анамнезе и отсутствием признаков заболеваний опорно-двигательного аппарата в целом. При установлении диагноза «фибромиалгия» перечисление определенного количества заранее определенных болезненных точек больше не требуется; вместо этого следует проводить оценку степени распространенной болезненности мягких тканей на основе чувствительности к пальпации в различных областях тела.
Наиболее важной диагностической особенностью при болевых синдромах, вызванных поражением опорно-двигательного аппарата грудной стенки, является болезненность грудной стенки при пальпации, которая последовательно воспроизводит характерный паттерн боли, испытываемой пациентом [6–7, 13]. Это считается диагностически значимым для синдрома грудной стенки. Многие синдромы грудной стенки определяются на основе расположения зон болезненности.
Осмотр ребер и грудной стенки начинается с оценки областей локализованного отека, таких как грудино-ключичные суставы и верхние костохондральные соединения. Затем следует прощупать суставы на обоих концах ключицы (акромиально-ключичные и грудино-ключичные суставы). По ходу грудины по средней линии может быть обнаружена болезненность рядом с грудинной мышцей, межреберными и мечевидными суставами или мечевидным отростком. Кроме того, следует искать болезненность в костохондральных соединениях по обе стороны грудины и над кончиками нижних ребер сбоку. В задней части грудной клетки дисфункция костовертебрального сустава может быть оценена путем пальпации в областях, расположенных сбоку от тел позвонков, или над пораженным ребром.
В дополнение к прямой пальпации были использованы различные маневры для воспроизведения боли в грудной стенке [18, 19].
Маневр «кукарекающий петух» выполняется, когда врач стоит позади пациента и оказывает тяговое усилие на предплечья, оттягивая их назад и немного выше (рис. 1).
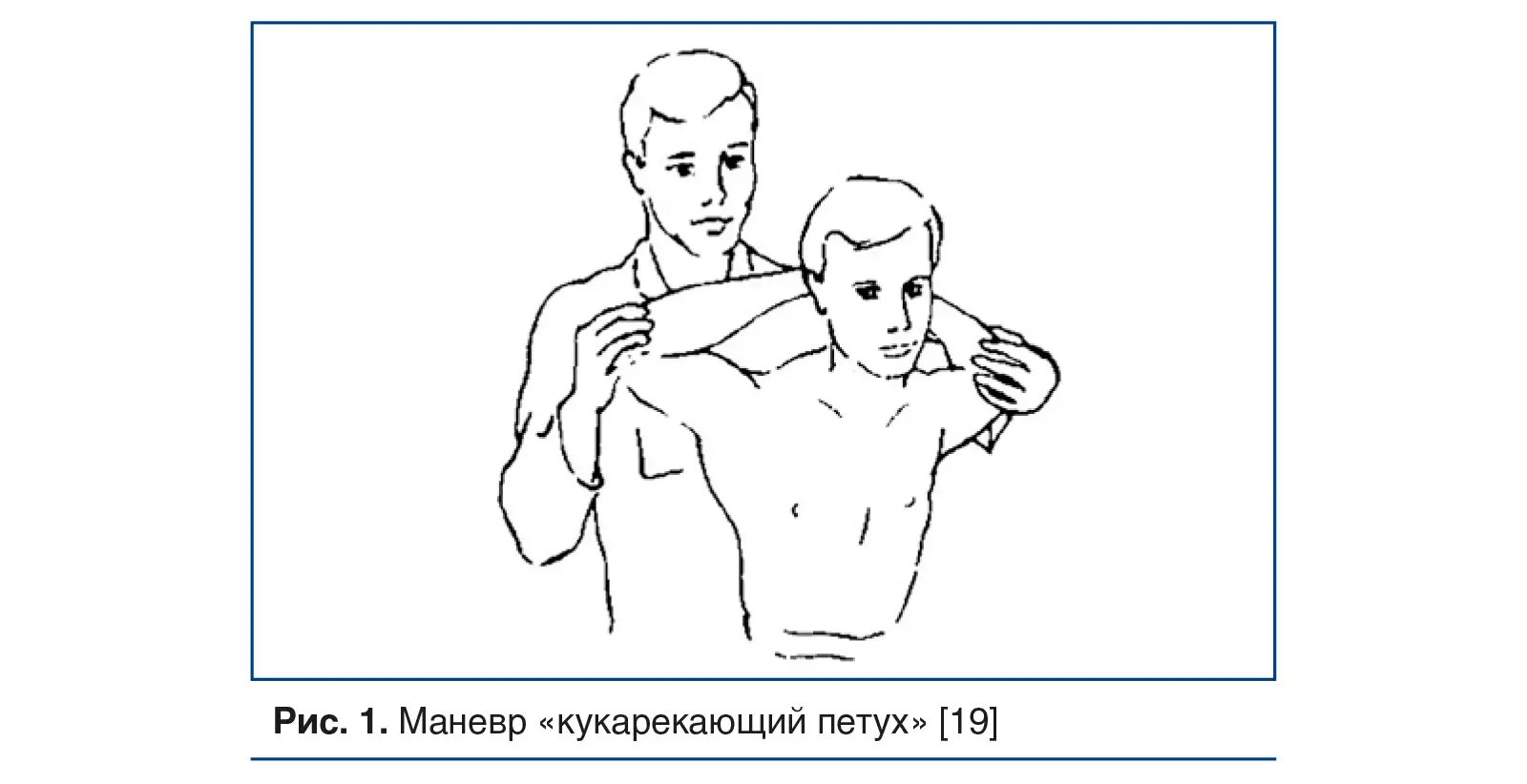
Маневр «горизонтальная тяга рычага» выполняется следующим образом: при горизонтальном сгибании руки она сгибается поперек передней части грудной клетки, при этом применяется устойчивая длительная тяга в горизонтальном направлении (рис. 2).
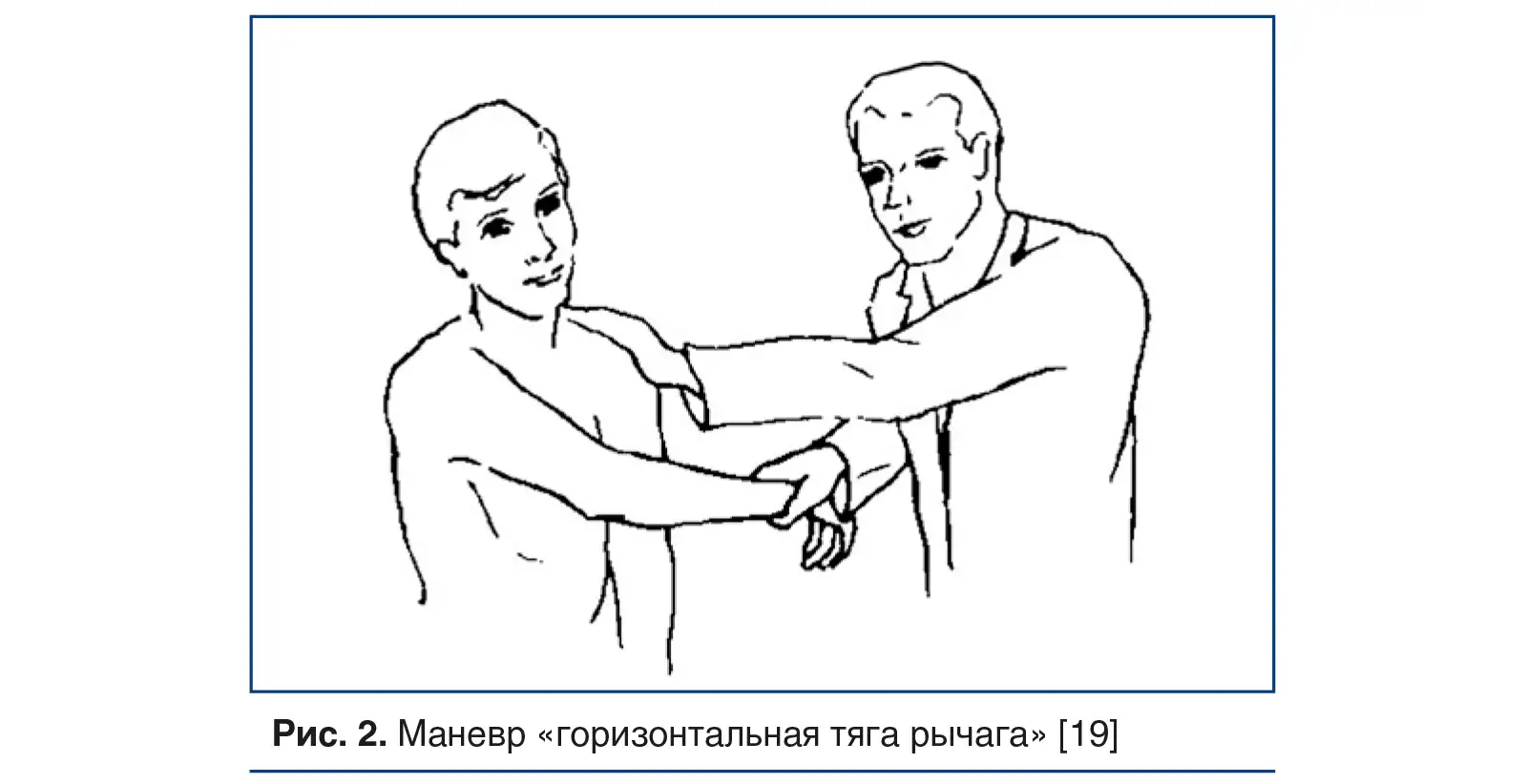
Как горизонтальное сгибание рук, так и маневр «кукарекающий петух» могут выполняться одновременно с разгибанием или вращением шеи.
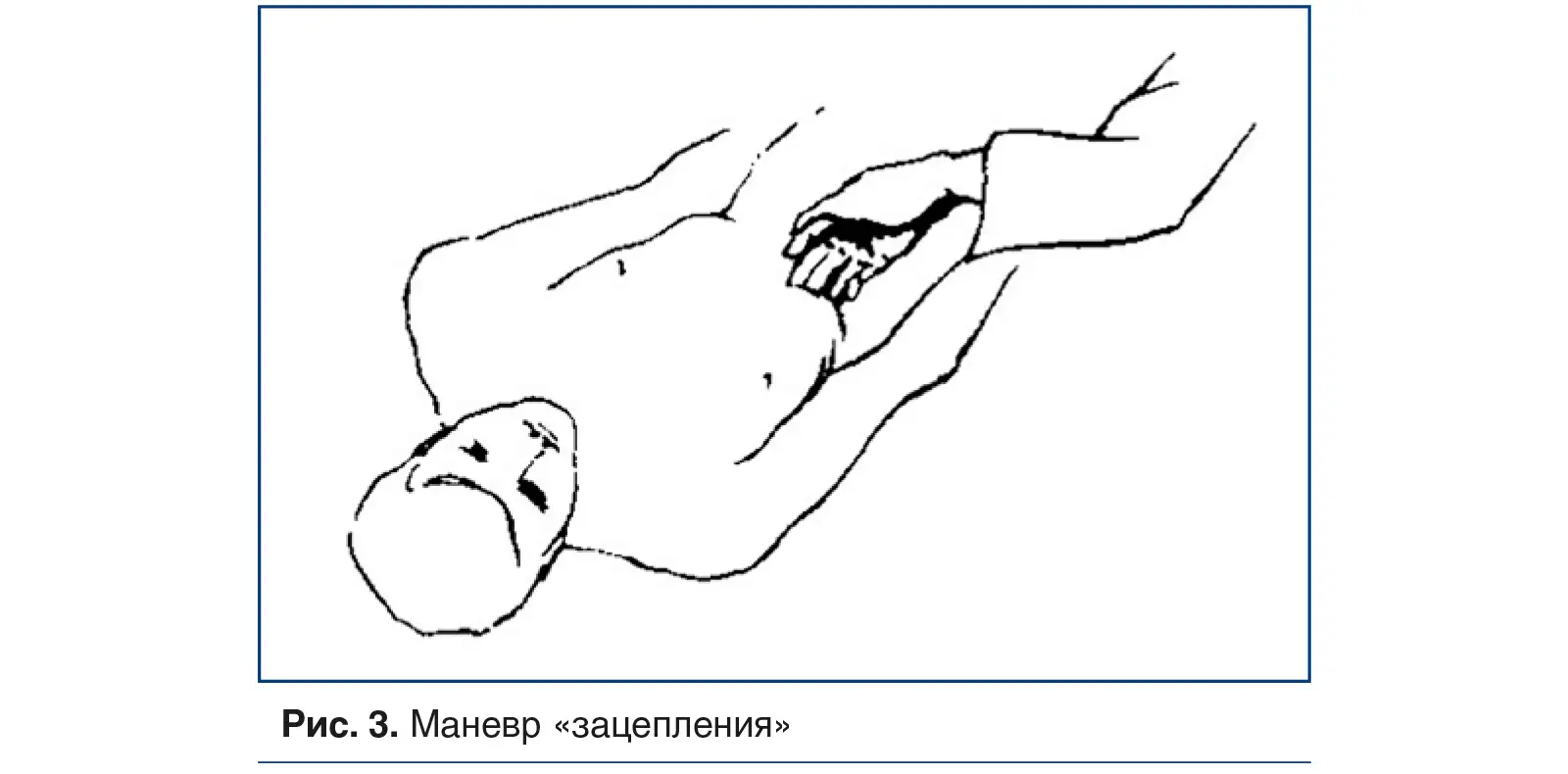
Маневр «зацепления», полезный для диагностики «синдрома скользящего ребра», выполняется путем зацепления пальцев за передние реберные края и вытягивания грудной клетки спереди (рис. 3) [20].
Клиническая характеристика пациентов, осмотренных на первичной консультации, представлена в таблице 1.
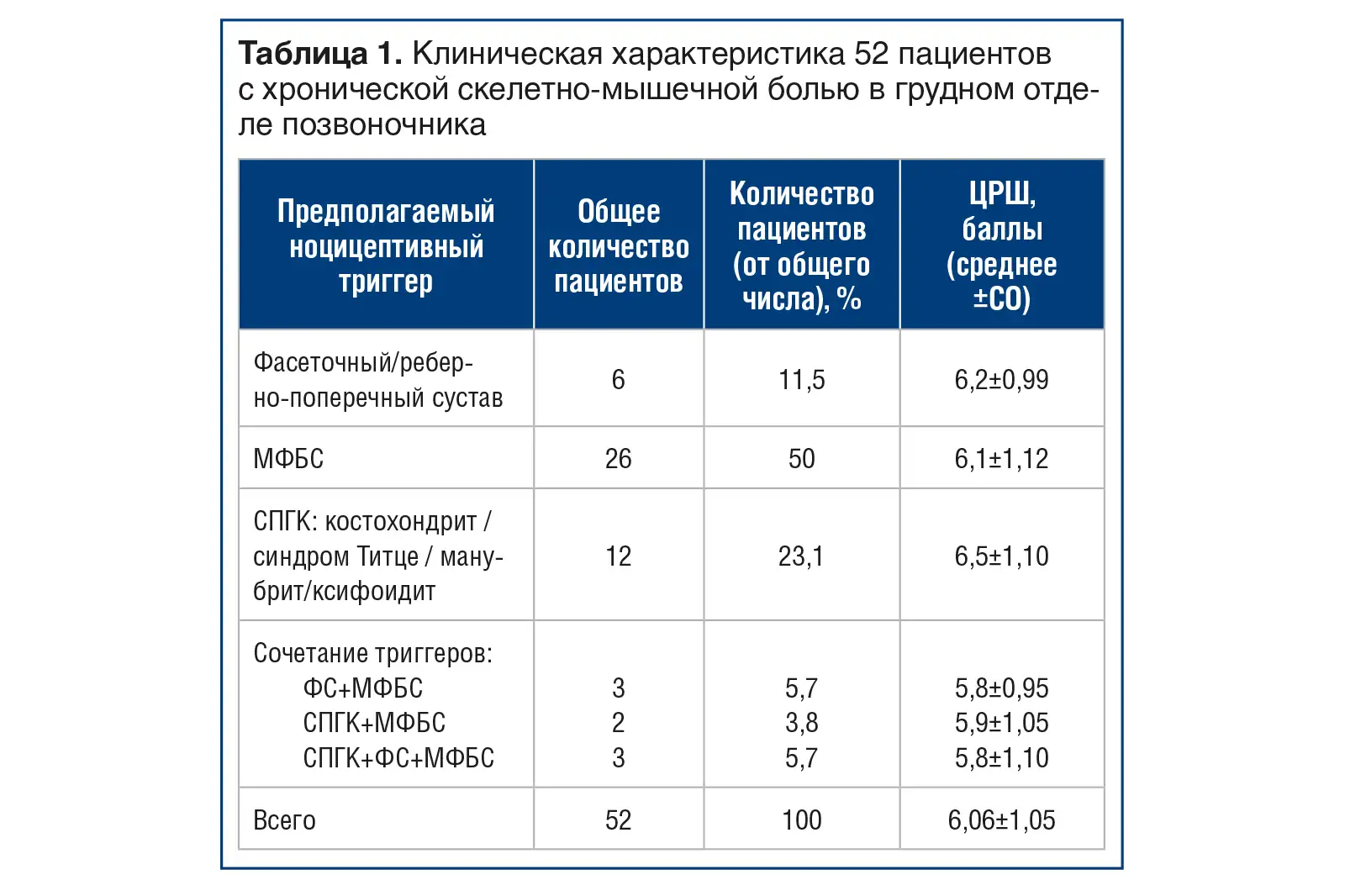
Остеоартрит суставов грудного отдела позвоночника (фасеточный сустав / реберно-поперечный сустав) на основании физикального осмотра выявлен у 12 (23,07%) пациентов, при этом изолированное поражение фасеточного сустава / реберно-поперечного сустава отмечалось у 6 (11,5%), а сочетанное поражение фасеточного сустава / реберно-поперечного сустава и паравертебральных мышц — у 9 (17,3%). Значимого отличия интенсивности болевого синдрома в этих группах по сравнению с другими группами не наблюдалось — различалась локализация боли и результаты нейроортопедического тестирования. Уточнить источник боли в задней грудной стенке, оценив вклад патологии фасеточного сустава и реберно-поперечных сочленений при физикальном осмотре с помощью нейроортопедических тестов и пальпации, не представляется возможным (для этого необходимо диагностическое введение местного анестетика в область вышеуказанных суставов под рентгенографическим или ультразвуковым контролем), поэтому данную группу пациентов мы объединили условно как ФС, тем более, что механизмы развития и патогенез болевого синдрома при остеоартрите этих суставов схожи, как и лечение данных нозологий.
На повторном визите 13 (25%) пациентов отметили значимое снижение боли (уменьшение до 1–2 баллов по ЦРШ) или ее регресс на фоне принимаемых препаратов, выполнения лечебных упражнений и соблюдения рекомендаций по двигательному режиму. Также 39 (75%) пациентов отметили уменьшение интенсивности болевого синдрома, вместе с тем к выполнению рекомендаций по кинезиотерапии относились негативно в связи с сохранением болевого синдрома. Пациентам этой группы лечение продолжено с применением интервенционной терапии (локального введения местного анестетика в область предполагаемого источника боли). Локальное введение местного анестетика использовано и для достоверной верификации ноцицептивного триггера. Распределение пациентов в зависимости от верифицированного ноцицептивного триггера и оценка клинической картины болевого синдрома представлены в таблице 2.
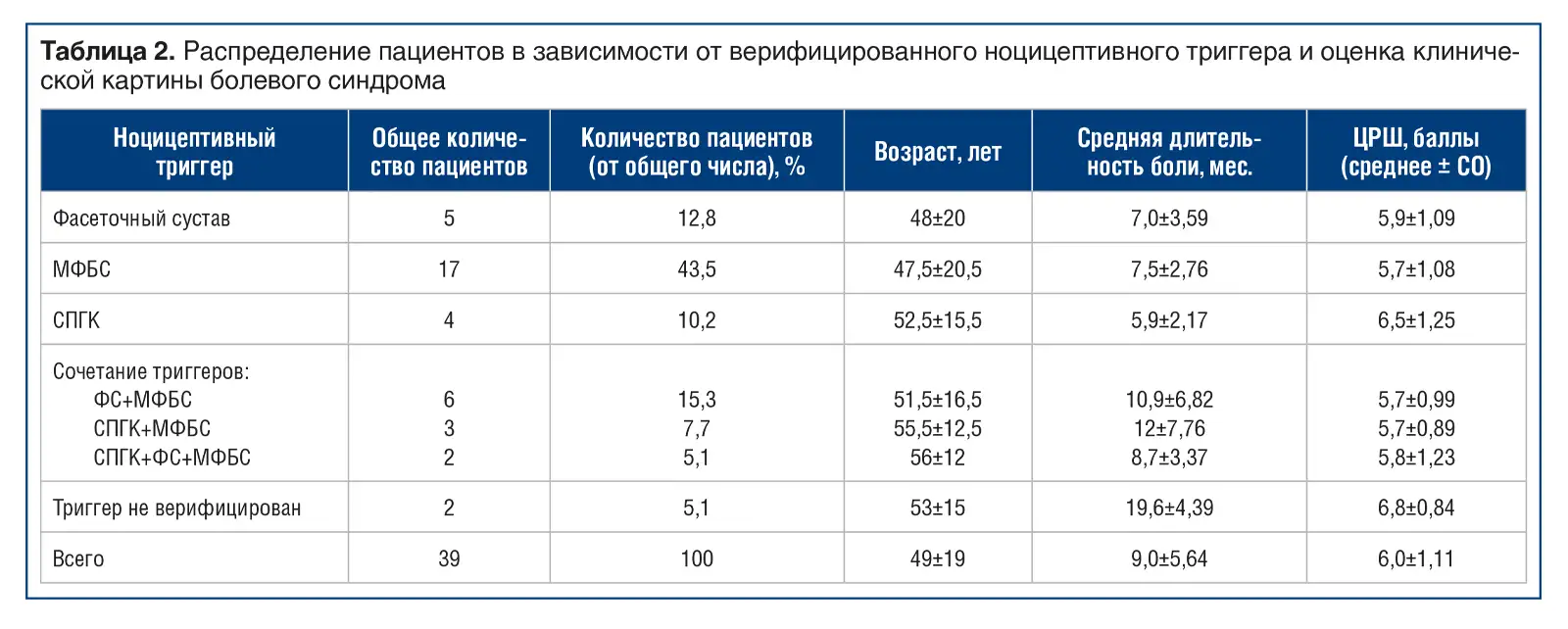
Фасеточный синдром был подтвержден у 8 пациентов (20,5%), при этом изолированное поражение фасеточного сустава было выявлено у 5 (12,8%) пациентов. Обращает на себя внимание тот факт, что длительность болевого синдрома у пациентов с комбинированным поражением ФС и МФБС была существенно больше (12±7,76 мес.), чем у пациентов с изолированными ФС (7,0±3,59 мес.) и МФБС (5,9±2,17). У 2 (5%) пациентов идентифицировать ноцицептивный триггер с помощью локального введения местного анестетика не удалось.
Пациентам был разъяснен доброкачественный характер и благоприятный прогноз заболевания; смоделирована концепция преодоления боли, включающая рекомендации по восстановлению повседневной активности с избеганием тех поз и движений, которые приводят к усилению боли, избеганием малоподвижного образа жизни; проведено обучение методам кинезиотерапии, эрготерапии, медикаментозной терапии (НПВП, миорелаксанты) в соответствии с международными стандартами оказания помощи пациентам с хронической болью в грудной клетке [21]. Лечение пациенты начинали уже после первого визита, повторный визит проводили на фоне терапии.
В качестве симптоматической терапии болевого синдрома пациенты с предполагаемым изолированным суставным болевым синдромом принимали НПВП (эторикоксиб 90–120 мг/сут), пациенты с признаками вовлечения мышцы в патологический процесс (МФБС и сочетанием нескольких ноцицептивных триггеров) принимали дополнительно миорелаксанты (тизанидин 4–6 мг/сут, толперизон 150–300 мг/сут, баклофен 15–30 мг/сут).
Повторная оценка боли и нейроортопедического обследования проведена через 2 дня неинвазивной консервативной терапии. Пациентам с сохраняющимся болевым синдромом с целью подтверждения источника болевой импульсации дважды последовательно выполнено введение в область болевого триггера местных анестетиков, различных по длительности действия (прокаина 0,5% 1,0 мл и ропивокаина 0,75% 1,0 мл) с интервалом 2 дня между инъекциями. Визуализация положения инъекционной иглы осуществлялась при помощи УЗ-навигации для фасеточного сустава и миофасциальных триггерных точек (МТТ). Для выявления МТТ проводилось УЗИ мышцы, выпрямляющей позвоночник с уточнением структуры и эхогенности мышечной ткани, дополнительно использовался режим энергетического допплера для определения зоны отсутствия эхо-сигналов в области болевого триггера.
Оценка интенсивности болевого синдрома по ЦРШ и степени нарушения жизнедеятельности по опроснику Освестри и шкале SF-12 проводилась после каждого лечебно-диагностического введения местного анестетика. Прием ранее назначенной симптоматической медикаментозной терапии продолжался до полного купирования болевого синдрома. На каждом визите с пациентами проводилась обучающая беседа, коррекция неверных представлений об источнике боли, модификация техники кинезиотерапии.
Отдельно показатели боли у пациентов с верифицированным ФС и реберно-поперечным синдромом (РПС) представлены в таблице 3.
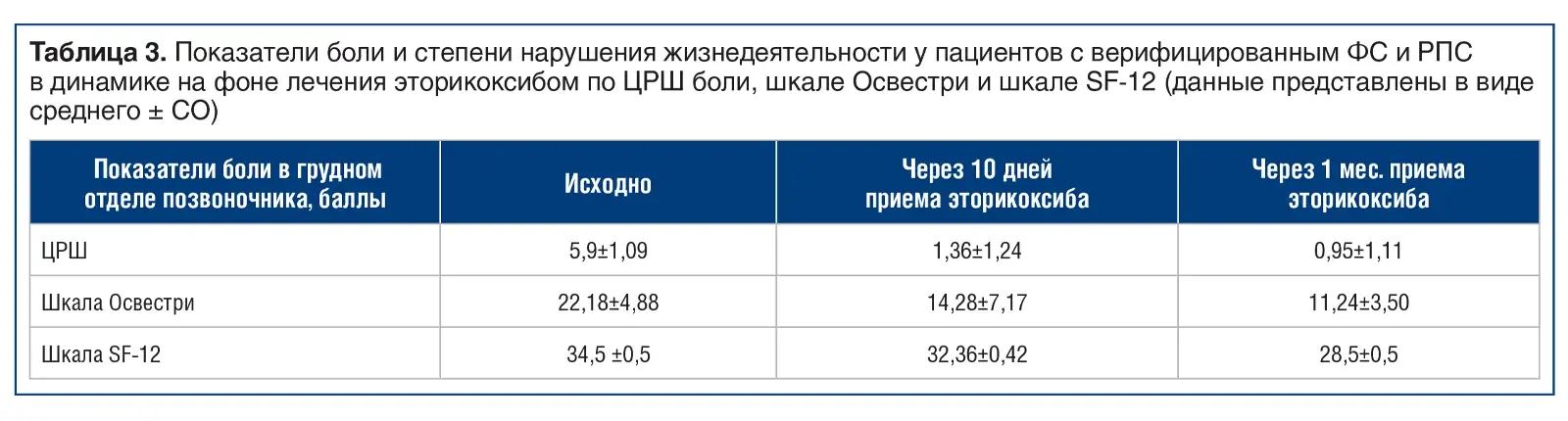
Из результатов, приведенных в таблице, следует, что на фоне проводимой симптоматической медикаментозной терапии отмечается уменьшение интенсивности болевого синдрома и снижение степени нарушения жизнедеятельности. Полученный после локальной инъекционной терапии обезболивающий эффект позволил повысить приверженность пациентов рекомендациям, касающимся кинезиотерапии, и расширению объема двигательной активности.
В настоящем исследовании представлен собственный опыт ведения пациентов со скелетно-мышечной болью в грудном отделе позвоночника, связанной с поражением ФС и РПС. ФС при нейроортопедическом обследовании был выявлен у 12 (23,07%) пациентов из 52 больных, получавших неинвазивную терапию, и подтвержден с помощью двукратного диагностического введения местного анестетика у 8 (20,5%) пациентов из 39 больных с недостаточным эффектом от двухнедельного курса неинвазивной терапии. Полученные данные свидетельствуют о высокой информативности клинического нейроортопедического обследования и в целом соответствуют результатам зарубежных исследований, согласно которым ФС в качестве источника болевой импульсации наблюдается у 7–33% пациентов с хронической болью в грудной клетке [22, 23]. Диагноз скелетно-мышечной боли в груди чаще ставится женщинам, чем мужчинам [6, 13, 24]. Полученные нами данные указывают на значительную распространенность ФС в структуре хронической боли в грудном отделе позвоночника у женщин зрелого возраста. Обращает на себя внимание клиническая неоднородность ФС в исследованной группе больных. Изолированное поражение фасеточных суставов верифицировано у 6 из 12 пациентов с ФС, а у 9 больных помимо суставного источника боли был выявлен МФБС паравертебральных мышц. У пациентов с сочетанием ФС и МФБС отмечалась большая продолжительность болевого синдрома (12±7,76 мес.), чем у пациентов с изолированным ФС (7,0±3,59 мес.) или изолированным МФБС (5,9±2,17 мес.).
Основным средством купирования боли являются НПВП. Именно на раннем этапе острой и подострой боли при помощи НПВП возможно воздействовать на выработку периферических медиаторов воспаления. В дальнейшем, когда включаются центральные патофизиологические механизмы боли, монотерапия обычными НПВП, не обладающими центральным действием, перестает быть эффективной. Для проявления центрального антиноцицептивного действия необходимо, чтобы НПВП попали в ЦНС из кровотока. Проникновение НПВП в спинной мозг и супраспинальные структуры (процесс, который осуществляется в основном за счет пассивной диффузии) различается у разных препаратов и зависит от степени связывания молекулы НПВП и белков плазмы крови — чем она ниже, тем выше проникновение через гематоэнцефалический барьер. Наивысшая способность к преодолению гематоэнцефалического барьера отмечается у эторикоксиба, что обусловливает его способность подавлять синтез простагландина Е2 в ЦНС и оказывать центральное действие при острых и хронических болевых синдромах. Анальгетический эффект эторикоксиба обусловлен не только подавлением синтеза медиаторов воспаления в фасеточных суставах, но также ингибированием центральных механизмов боли, связанных с сенситизацией, что подтверждается достоверным уменьшением периферической и центральной сенситизации у пациентов с остеоартритом, принимавших эторикоксиб, по сравнению с принимавшими плацебо [25].
Фармакокинетические исследования демонстрируют способность высокоселективного НПВП — эторикоксиба проникать через гематоэнцефалический барьер в концентрациях, достаточных для подавления ЦОГ-2 [26]. В 2016 г. опубликованы результаты одного из первых клинических исследований влияния эторикоксиба на центральные механизмы возникновения и поддержания боли [18]. Эти находки позволяют рассматривать, в частности, новый дженерик эторикоксиба Долококс® как целевой противовоспалительный препарат, воздействующий на периферические и, с высокой долей вероятности, на центральные механизмы хронической боли. Наличие комплексного двойного механизма действия у эторикоксиба, возможно, объясняет более высокую анальгетическую активность этого препарата даже в тех случаях, когда другие НПВП при длительном приеме оказывают недостаточное обезболивающее действие [14].
Лечение болевого эпизода НПВП следует начинать как можно раньше, желательно в первые дни появления боли.
Кроме того, раннее воздействие на воспалительные процессы, сопровождающие боль в спине, позволяют предупредить центральную сенситизацию и, соответственно, снизить риск перехода острой боли в хроническую боль. Чрезмерно длительное соблюдение постельного режима может отрицательно сказаться на состоянии межпозвонковых дисков, мышечного каркаса, привести к общей дезадаптации, снижению мотивации на противостояние боли. Важно на ранних этапах контролировать боль, что, безусловно, предполагает использование обезболивающих средств, воздействующих как на периферические, так и на центральные механизмы боли.
В этом аспекте интерес представляет эторикоксиб в первую очередь благодаря особенностям его фармакодинамики. Эторикоксиб обладает биодоступностью, приближающейся к 100%, и его пиковая концентрация в крови достигается через 1–3 ч после перорального приема. Известно, что скорость наступления обезболивающего действия лекарственного препарата зависит от нарастания его концентрации в плазме крови. По быстроте действия эторикоксиб не уступает любым НПВП, используемым для ургентного обезболивания, в том числе и инъекционным формам. Так, на модели острой боли после стоматологических операций было показано, что при пероральном приеме эторикоксиба в дозе 120 мг обезболивающий эффект наступает уже через 24 мин [27, 28]. Период полувыведения эторикоксиба составляет 22 ч, что позволяет назначать препарат 1 р/сут. Таким образом, после однократного приема стабильное обезболивающее и противовоспалительное действие эторикоксиба наступает быстро и сохраняется длительно.
Наибольшее обезболивающее действие эторикоксиба по сравнению с другими НПВП подтверждает метаанализ РКИ пероральной анальгетической терапии при остеоартрите, который продемонстрировал достоверно большее снижение боли по шкале WOMAC на фоне приема эторикоксиба [14, 26].
Полученные нами данные о большей продолжительности болевого синдрома у пациентов с сочетанием МФБС и ФС позволяют предположить патогенетическую взаимосвязь сочетанного вовлечения в процесс формирования хронического болевого синдрома источников ноцицептивной импульсации позвоночного двигательного сегмента и приводящих его в движение паравертебральных мышц.
Многообразие лекарственных и нелекарственных методов лечения и широкий выбор фармацевтических способов купирования боли в ряде случаев не обеспечивает полноценного и долговременного обезболивающего действия при хронической боли в грудном отделе позвоночника. Для успешного персонифицированного лечения скелетно-мышечной боли в грудном отделе необходима адекватная диагностика с выявлением преобладающих у больного источников болевой импульсации (триггеров), в том числе с использованием малоинвазивных методов диагностики — локального введения раствора местного анестетика в предполагаемый триггер боли.
Анализ полученных результатов показал, что болевой синдром с течением времени проходит трансформацию (ФС чаще сочетается с МФБС), что указывает на пластичность в работе ноцицептивной системы. Дифференцированный подход в определении источника болевой импульсации помогает быстро уменьшить интенсивность болевого синдрома, повышает у пациентов стимул к выполнению рекомендаций доктора по расширению двигательного режима и модификации образа жизни, значительно повышает физическую активность пациентов.
ЗАКЛЮЧЕНИЕ
Понимание механизма развития хронической боли в грудном отделе позвоночника у конкретного пациента позволяет рекомендовать персонифицированную терапию, направленную на устранение не только симптомов, но и первопричины заболевания. Применение эторикоксиба, демонстрирующего анальгетическое действие у больных с остеоартритом, патогенетически оправдано и должно сочетаться с нелекарственными методами лечения хронической боли в грудном отделе позвоночника, связанной с остеоартритом фасеточных суставов и реберно-позвоночных сочленений.
Благодарность
Редакция благодарит компанию ООО «Др. Реддис Лабораторис» за оказанную помощь в технической редактуре настоящей публикации.
__________
Литература
1. Stochkendahl M.J., Christensen H.W. Chest pain in focal musculoskeletal disorders. Med Clin North Am. 2010;94(2):259–273. DOI: 10.1016/j.mcna.2010.01.007.
2. Mandrekar S., Venkatesan P., Nagaraja R. Prevalence of musculoskeletal chest pain in the emergency department: a systematic review and meta-analysis. Scand J Pain. 2021;21(3):434–444. DOI: 10.1515/sjpain-2020-0168.
3. Yelland M., Cayley W.E. Jr., Vach W. An algorithm for the diagnosis and management of chest pain in primary care. Med Clin North Am. 2010;94(2):349–374. DOI: 10.1016/j. mcna.2010.01.011.
4. Verdon F., Bernard B., Herzig L. et al. Chest wall syndrome in primary care patients: a cohort study. BMC Fam Pract. 2007;8:51. DOI: 10.1186/1471-2296-8-51.
5. Bösner S., Becker A., Hani M.A. et al. Chest wall syndrome in primary care patients with chest pain: presentation, associated features and diagnosis. Fam Pract. 2010;27(4):363–369. DOI: 10.1093/fampra/cmq024.
6. Zaruba R.A., Wilson E. Impairment based examination and treatment of costochondritis: a case series. Int J Sports Phys Ther. 2017;12(3):458–467. PMID: 28593100.
7. Cunningham R., Walton M.A., Weber J.E. et al. One-year medical outcomes and emergency department recidivism after emergency department observation for cocaine-associated chest pain. Ann Emerg Med. 2009;53(3):310–320. DOI: 10.1016/j. annemergmed.2008.07.018.
8. Roche T., Gardner G., Lewis P. Retrospective observational study of patients who present to Australian rural emergency departments with undifferentiated chest pain. Aust J Rural Health. 2014;22(5):229–234. DOI: 10.1111/ajr.12134.
9. Кургузов О.П., Соломка Я.А., Кузнецов Н.А. Синдром Титце. Хирургия. 1991;9:161–169. [Kurguzov O.P., Solomka Ya.A., Kuznetsov N.A. Titze syndrome. Surgery. 1991;9:161–169 (in Russ.)].
10. Bjørnsen L.P., Naess-Pleym L.E., Dale J. et al. Description of chest pain patients in a Norwegian emergency department. Scand Cardiovasc J. 2019;53(1):28–34. DOI: 10.1080/14017431.2019.1583362.
11. Wertli M.M., Dangma T.D., Müller S.E. et al. Non-cardiac chest pain patients in the emergency department: Do physicians have a plan how to diagnose and treat them? A retrospective study. PLoS One. 2019;14(2):e0211615. DOI: 10.1371/journal. pone.0211615.
12. Verdon F., Herzig L., Burnand B. et al. Chest pain in daily practice: occurrence, causes and management. Swiss Med Wkly. 2008;138(23–24):340–347. PMID: 18561039.
13. Подчуфарова Е.В. Боль в грудной клетке. Трудный пациент. 2003;1(1):4–9. [Podchufarova E.V. Chest pain. Difficult Patient. 2003;1(1):4–9 (in Russ.)].
14. Подчуфарова Е.В., Яхно Н.Н. Боль в спине. М.: ГЭОTАР-медиа; 2010. [Podchufarova E.V., Yakhno N.N. Back pain. M.: GEOTAR-media; 2010 (in Russ.)].
15. Briggs A.M., Smith A.J., Straker L.M., Bragge P. Thoracic spine pain in the general population: prevalence, incidence and associated factors in children, adolescents and adults. A systematic review. BMC Musculoskelet Disord. 2009;10:77. DOI: 10.1186/1471- 2474-10-77.
16. Насонов Е.Л., Яхно Н.Н., Каратеев А.Е. и др. Общие принципы лечения скелетно-мышечной боли: междисциплинарный консенсус. Научно-практическая ревматология. 2016;3(54):247–265. DOI: 10.14412/1995-4484-2016-247-265. [Nasonov E.L., Yakhno N.N., Karateev A.E. et al. General principles of treatment of musculoskeletal pain: interdisciplinary consensus. Scientific and practical rheumatology. 2016;3(54):247- 265 (in Russ.)]. DOI: 10.14412/1995-4484-2016-247-265.
17. Epstein S.E., Gerber L.H., Borer J.S. Chest wall syndrome. A common cause of unexplained cardiac pain. JAMA. 1979;241(26):2793–2797. DOI: 10.1001/ jama.241.26.2793.
18. Foley C.M., Sugimoto D., Mooney D.P. et al. Diagnosis and Treatment of Slipping Rib Syndrome. Clin J Sport Med. 2019;29(1):18–23. DOI: 10.1097/JSM.0000000000000506.
19. Levine P.R., Mascette A.M. Musculoskeletal chest pain in patients with "angina": a prospective study. South Med J. 1989;82(5):580–585,591. DOI: 10.1097/00007611- 198905000-00010.
20. Qaseem A., Wilt T.J., McLean R.L. et al. Noninvasive Treatments for Acute, Subacute, and Chronic Low Back Pain: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med. 2017;166(7):514–530. DOI: 10.7326/M16-2367.
21. Perolat R., Kastler A., Nicot B. et al. Facet joint syndrome: from diagnosis to interventional management. Insights Imaging. 2018;9(5):773–789. DOI: 10.1007/s13244- 018-0638x.
22. Datta S., Lee M., Falco F.J. et al. Systematic assessment of diagnostic accuracy and therapeutic utility of lumbar facet joint interventions. Pain Physician. 2009;12(2):437– 460. PMID: 19305489.
23. Hoorweg B.B., Willemsen R.T., Cleef L.E. et al. Frequency of chest pain in primary care, diagnostic tests performed and final diagnoses. Heart. 2017;103(21):1727–1732. DOI: 10.1136/heartjnl-2016-310905.
24. Treede R.D. The International Association for the Study of Pain definition of pain: as valid in 2018 as in 1979, but in need of regularly updated footnotes. Pain Rep. 2018;3(2):e643. DOI: 10.1097/PR9.0000000000000643.
25. Подчуфарова Е.В. Скелетно-мышечные боли в грудной клетке. Consilium medicum. 2006;8(8):17–21. [Podchufarova E.V. Musculoskeletal pain in the chest. Consilium medicum. 2006;8(8):17–21 (in Russ.)].
26. Pergolizzi J., Ahlbeck K., Aldington D. et al. The chronic pain conundrum: should we CHANGE from relying on past history to assessing prognostic factors? Curr Med Res Opin. 2012;28(2):249–256. DOI: 10.1185/03007995.2011.651525.
27. Arendt-Nielsen L., Egsgaard L.L., Petersen K.K. Evidence for a central mode of action for etoricoxib (COX-2 Inhibitor) in patients with painful knee osteoarthritis. Pain. 2016;157(8):1634–1644. DOI: 10.1097/j.pain.000000000000056.
28. Jung S.Y., Jang E.J., Nam S.W. et al. Comparative effectiveness of oral pharmacologic interventions for knee osteoarthritis: A network meta-analysis. Mod Rheumatol. 2018;28(6):1021–1028. DOI: 10.1080/14397595.2018.1439694.
РМЖ, 2022 №3
Е.В. Яковлева, к.м.н. А.Н. Баринов
Комментарии (2)