Категории
Сменить пароль!
Сброс пароля!


Функциональная диспепсия (ФД) и хронический гастрит — заболевания с разными причинами и механизмами развития, однако иногда они могут протекать сочетанно [1[. В этом случае в качестве симптоматического лечения пациентам могут быть рекомендованы ингибиторы протонной помпы и прокинетики, например, в виде фиксированной комбинации домперидон + омепразол [2]. Для того, чтобы узнать, насколько такое назначение целесообразно с точки зрения терапевтического действия и переносимости, в 2022 году учёные провели исследование TANDEM [3].
Функциональная диспепсия (ФД) и хронический гастрит — заболевания с разными причинами и механизмами развития, однако иногда они могут протекать сочетанно [1[. В этом случае в качестве симптоматического лечения пациентам могут быть рекомендованы ингибиторы протонной помпы и прокинетики, например, в виде фиксированной комбинации домперидон + омепразол [2]. Для того, чтобы узнать, насколько такое назначение целесообразно с точки зрения терапевтического действия и переносимости, в 2022 году учёные провели исследование TANDEM [3].
Резюме.
В проспективном обсервационном исследовании TANDEM проведена оценка эффективности и переносимости терапии фиксированной комбинации омепразол-домперидон (препарат Омез® ДСР) в лечении функциональной диспепсии. Материалы и методы. В соответствии с целью исследования была сформирована исследовательская когорта из 50 пациентов с симптомами функциональной диспепсии, соответствующим критериям IV Римского консенсуса (2016) (30 мужчин, 20 женщин). Средний возраст составил 29,06 (25,88-32,25). Оценка эффективности и переносимости проводилась с использованием визуально-аналоговой шкалы и шкалы Ликерта. Полученные результаты. Исследование закончили 47 больных.
Оценка эффективности применения Омез® ДСР в лечении функциональной диспепсии у пациентов с хроническим Нр-негативным гастритом продемонстрировала 100% эффективность препарата в купировании симптомов. через 4 недели от момента начала терапии. Через 72 часа от начала применения Омез® ДСР эффект в виде полного купирования симптомов зарегистрирован у 87,25% больных. На 14 день применения Омез® ДСР симптомы полностью купированы у 95,74% больных. Оценка переносимости применения Омез® ДСР в лечении функциональной диспепсии у пациентов с хроническим Нр-негативным гастритом через 4 недели от момента начала терапии препаратом Омез® ДСР продемонстрировала хороший профиль безопасности препарата, в частности, отсутствии клинически значимых изменений интервала QT.
Актуальность.
Симптомы диспепсии относят к наиболее часто встречающимся проявлениям гастроэнтерологических заболеваний [1]. В условиях первичной медико-санитарной помощи больные с диспепсией составляют около 2–7% обращений [2]. Среди гастроэнтерологических больных около 50% пациентов имеют диспепсические жалобы [3-6].
У пациентов с хроническим Нelicobacter рylori – ассоциированным гастритом эрадикация инфекции является терапией I линии [2].
У больных с функциональной диспепсией (ФД) и отрицательным результатом исследования на Нр ингибиторы протонной помпы (ИПП) и прокинетики являются препаратами выбора [2]. Нередко, пациенты с ФД нуждаются в проведении комбинированной терапии (ИПП + прокинетик), т.к. по механизмам развития ФД является многофакторным заболеванием, и сочетание лекарственных препаратов с различным механизмом действия, позволяет оптимально воздействовать на различные звенья патогенеза. Об этом свидетельствует многолетний опыт применения фиксированных комбинаций в кардиологии, где назначение фиксированных комбинаций препаратов, принадлежащих разным классам, демонстрирует более выраженный эффект, чем применение тех же препаратов отдельно [7].
Получение дополнительных сведений об эффективности и переносимости применения фиксированной комбинации ИПП и прокинетика позволит клиницисту решить ряд вопросов с выбором рациональной фармакотерапии при курации больных.
Цель исследования
Оценить эффективность и переносимость применения препарата Омез® ДСР в лечении функциональной диспепсии у пациентов с хроническим Helicobacter pylori негативным гастритом после курсового лечения в течение 4 недель.
Материалы и методы.
В 2022 году нами выполнено проспективное обсервационное исследование TANDEM по оценке эффективности и переносимости Омез ДСР у пациентов с ФД (evaluaTion of the efficAсy aNd portability of Qmez DSR in the trEatMenf of functional dyspepsia in patients with chronic Hp-negative gastritis или сокращенно TANDEM).
В соответствии с критериями включения и невключения была сформирована исследовательская когорта из 50 пациентов с симптомами функциональной диспепсии, соответствующим критериям IV Римского консенсуса (2016) [8]. 30 мужчин, 20 женщин. Средний возраст составил 29,06 (25,88-32,25). Клинический осмотр и обследование пациентов проводилось в Западно-Сибирском Медицинском Центре Федерального медико-биологического агентства (г. Омск), являющегося клинической базой кафедры внутренних болезней и семейной медицины ФГБОУ ВО «Омского государственного медицинского университета» Минздрава России.
Критериями включения пациентов в исследование были: пациенты (мужчины и женщины) в возрасте от 18 до 65 лет включительно; установленные диагнозы «хронический гастрит» и «функциональная диспепсия», сопровождающиеся одним или несколькими характерными симптомами (чувство жжения в желудке, боль в желудке, вздутие живота, чувство переполнения в желудке после приема пищи, чувство быстрого насыщения); отрицательный тест на Helicobacter pylori, проведенный в течение 6 мес. до момента скрининга (дыхательный уреазный тест или гистологическое исследование); пациенты, которым лечащий врач в условиях реальной клинической практики назначил Омез® ДСР для лечения функциональной диспепсии; подписанное и датированное информированное согласие на участие в исследовании; способность пациента понять правила исследования, готовность им следовать.
Критерии невключения в исследование: беременность, лактация или планирование беременности в период исследования; наличие у пациента гастроэзофагеальной рефлюксной болезни, в том числе пищевода Барретта, инфекция Helicobacter pylori в течение последних 6 месяцев; известное или предполагаемое злокачественное новообразование на момент скрининга или в предшествующие 2 года, пролактин-секретирующая опухоль гипофиза (пролактинома); эрозивно-язвенные заболевания органов ЖКТ на момент скрининга или по данным анамнеза (в том числе язвенная болезнь желудка и двенадцатиперстной кишки, болезнь Крона, неспецифический язвенный колит); желудочно-кишечные кровотечения и внутричерепные кровоизлияния по данным анамнеза; механическая непроходимость кишечника или перфорация органов ЖКТ по данным анамнеза; желчнокаменная болезнь по данным анамнеза; психические и/или неврологические заболевания с частичной или полной утратой дееспособности; диагностированная умеренная или тяжелая хроническая почечная недостаточность по данным анамнеза; умеренные и тяжелые нарушения функции печени по данным анамнеза (любые острые заболевания печени на момент скрининга, токсические поражения печени в анамнезе, цирроз печени, декомпенсированная печеночная недостаточность); операции на ЖКТ в анамнезе (за исключением аппендэктомии: допустимо включать в исследование пациентов, которым провели аппендэктомию > 6 мес. до момента скрининга); хроническая сердечная недостаточность (в том числе компенсированная); другие хронические некомпенсированные заболевания сердечно-сосудистой, дыхательной и эндокринной систем; применение, в том числе и разовое, нестероидных противовоспалительных препаратов (НПВП) в любой лекарственной форме в течение последних 2 недель до визита скрининга; другие заболевания, наличие которых, с точки зрения врача-исследователя подвергают здоровье пациента риску в случае участия в исследовании или потенциально затрудняют интерпретацию результатов обследования (может оказать влияние на оценку конечных точек); повышенная чувствительность к компонентам препарата и бензимидазолам; непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция; дефицит сахаразы/изомальтазы, непереносимость фруктозы; одновременный прием ингибиторов цитохрома P450 (cytochrome P450, CYP) 3A4, вызывающих удлинение интервала QT; злоупотребление алкоголем, употребление наркотиков; участие в другом клиническом исследовании в течение 90 дней до скрининга.
Три пациента в ходе проведения исследования были исключены из-за несоблюдения протокола исследования.
Обследование проводилось во время трех визитов, первый и второй визиты проводились в исследовательском центре, третий — посредством телефонного контакта.
Всем пациентам до включения в исследование был назначен препарат Омез® ДСР, производитель Др. Редди’с Лабораторис (Индия). Лекарственная форма: Капсулы с модифицированным высвобождением. Действующие вещества: омепразол 20 мг (в составе пеллет с кишечнорастворимым покрытием 267 мг), домперидон 30 мг (в составе пеллет с пролонгированным высвобождением 100 мг). Домперидон модифицированного высвобождения нормализует работу нижнего пищеводного сфинктера, улучшает антродуоденальную координацию, оказывает центральный антиэметический эффект. Омепразол, входящий в состав препарата, уменьшает активность кислотно-пептического фактора и потенцирует эффект прокинетика [9].
Пациентам были даны рекомендации принимать препарат внутрь натощак, за 20–30 мин до еды (содержимое капсулы не разжевывать), запивая небольшим количеством воды 1 раз в сутки утром. Длительность курса лечения составила 4 недели.
Второй визит проводился через 30 ± 2 дней терапии, третий визит в виде был проведен на 35 ± 2 день исследования.
В качестве критериев для оценки выраженности симптомов взяты опросники ВАШ и шкала Ликерта[10]. 10-см шкала ВАШ позволяла оценить баллы 4 основных симптомов функциональной диспепсии по отдельности и в сумме: чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения. 0 баллов (минимальный балл) соответствовал полному отсутствию вышеуказанных симптомов, 10 или 40 баллов суммарно (максимальный балл) – максимальной степени выраженности вышеуказанных симптомов. Выраженность боли в эпигастральной области и/или дискомфорта в эпигастральной области (в случае отсутствия боли в эпигастральной области оценивалась только степень дискомфорта) оценивалась также по 7-балльной шкале Ликерта исследователем при расспросе пациента [10]:
Кроме того, по 7-балльной шкале Ликерта проведена оценка эффективности лечения пациентом:
Глобальная оценка исследователем эффективности и переносимости терапии оценивалась по 5-балльной шкале Ликерта:
По окончании терапии пациент оценивал удовлетворенность проводимым лечением по 5-балльной шкале Ликерта, где:
На Визите 1, совпадающим с визитом скрининга, были выполнены следующие процедуры: сбор жалоб, оценка сопутствующей терапии, физикальное обследование, оценка жизненно важных показателей (температура тела, артериальное давление (АД), частота сердечных сокращений (ЧСС), частота дыхательных движений (ЧДД); в рамках рутинной практики были проведены: электрокардиография (ЭКГ) в 12 отведениях, клинический анализ крови, общий анализ мочи, биохимический анализ крови, ультразвуковое исследование (УЗИ) органов желудочно-кишечного тракта (ЖКТ); оценены критерии включения /невключения, подписано информированное согласие, выдан дневник пациента, проведено инструктирование пациента по заполнению дневника пациента; проведена оценка выраженности боли в эпигастральной области и/или дискомфорта в эпигастральной области по 7-балльной шкале Ликерта, оценка выраженности 4 симптомов функциональной диспепсии (чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения) по 10-сантиметровой ВАШ.
На Визите 2 (окончание лечения, 30 ± 2 день) проводились следующие процедуры: сбор жалоб, оценка сопутствующей терапии, физикальное обследование, оценка жизненно важных показателей (температура тела, АД, ЧСС, ЧДД), контроль заполнения дневника пациента, оценка выраженности боли в эпигастральной области и/или дискомфорта в эпигастральной области по 7-балльной шкале Ликерта, оценка выраженности 4 симптомов функциональной диспепсии (чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения) по 10-сантиметровой ВАШ, электрокардиография (ЭКГ) в 12 отведениях, оценка пациентом эффективности лечения, оценка пациентом удовлетворенности лечением, оценка врачом эффективности и переносимости лечения, возврат и проверка дневника пациента; регистрация нежелательных реакций (НР) / серьезных нежелательных реакций (СНР); оценка критериев исключения.
Продолжительность участия пациентов в исследовании составила 35 ± 2 дней, максимальная длительность составила 37 дней.
В качестве конечных точек в исследовании были выбраны следующие показатели:
Первичная конечная точка. Изменение суммы баллов интенсивности 4 основных симптомов функциональной диспепсии (чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения) при измерении каждого симптома по 10-см ВАШ к Визиту 2.
Вторичные конечные точки:
Основные параметры переносимости:
Исследование было одобрено Независимым междисциплинарным Комитетом по этической экспертизе клинических исследований. Выписка из протокола № 11 от 24.06.2022.
Каждый участник подписывал форму информированного согласия на обследование согласно Хельсинской декларации Всемирной медицинской ассоциации, регламентирующей проведение научных исследований.
Результаты исследований оценивались согласно общепринятым методам статистического анализа STATISTICA 10, возможностей программы Microsoft Excel. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05. При этом значения p могли ранжироваться по 3 уровням достигнутых статистически значимых различий: p<0,05; p<0,01; p<0,001. Проверка нормальности распределения производилась с использованием критерия Шапиро-Уилки.
Характеристика исследуемой когорты.
Исследование завершили 47 пациентов (29 мужчин, 18 женщин). Средний возраст участников составил 29,06 (25,88-32,25) лет. Среди них: курящих – 4, сопутствующие заболевания выявлены у 6 пациентов (ожирение 1-2 степени у 5; артериальная гипертензия у 1 пациента).
Описательная статистика демографических и антропометрических параметров представлена в таблице 1.
Таблица 1. Демографические и антропометрические данные пациентов
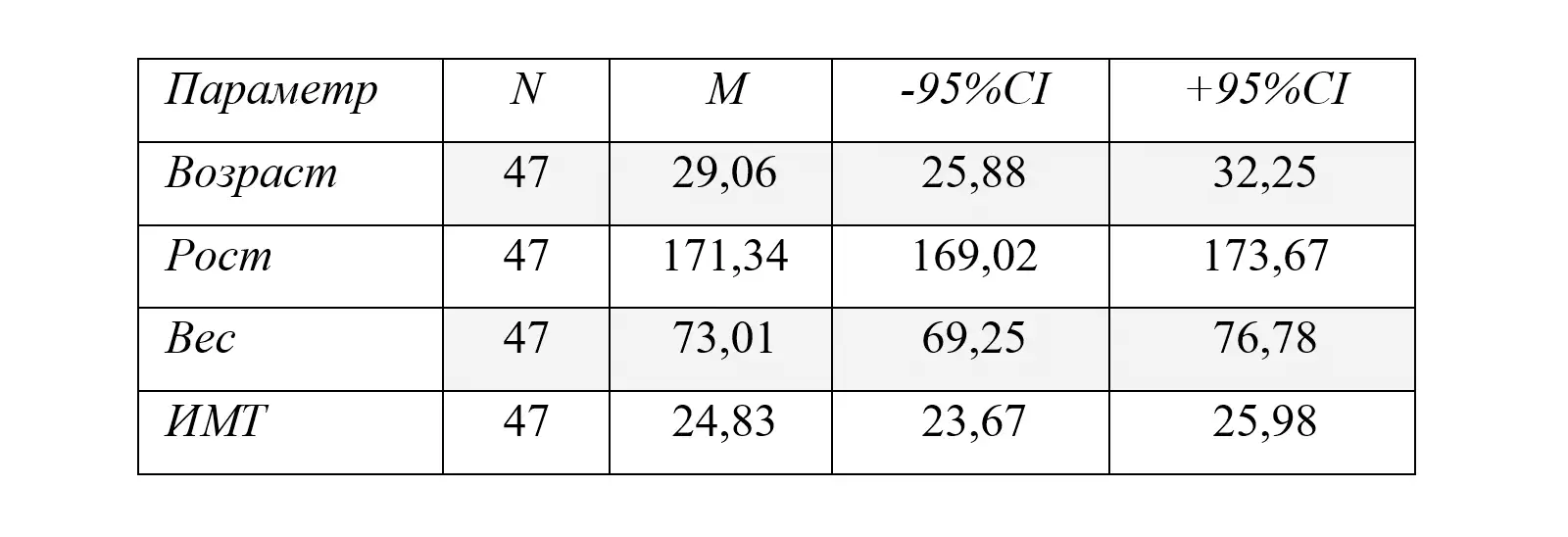
Рисунок 1. Варианты функциональной диспепсии в исследуемой группе и их сочетание.
ППДС — постпрандиальный дистресс синдром, СЭБ — синдром эпигастральной боли, Т\О — тошнота или отрыжка.
У 33(70,21%) пациентов с ФД регистрировались проявления ППДС, у 14 (29,79%) – СЭБ, перекрест симптомов ППДС и СЭБ наблюдался у 4 (8,51%) пациентов, тошнота или отрыжка в сочетании с СЭБ присутствовали у 7 (14,89 %), в сочетании с ППДС – у 8 (17,02%) пациентов, тошнота в сочетании с СЭБ и ППДС зарегистрирована у одного пациента (2,13%). Таким образом, преобладающими в клинической картине ФД были проявления ППДС (70,21%, р<0,05), у 40,43% заболевание протекало в виде перекреста различных симптомов.
Оценка первичной конечной точки.
На этапе включения пациентов в исследование (Визит 1) оценка симптомов по шкале Ликерта соответствовала умеренным проявлениям ФД, средний показатель по группе составил 2,77(2,47-3,06). Средние показатели по 10-сантиметровой ВАШ суммы баллов интенсивности 4 основных симптомов (чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения) составили 8,36 (7,06-9,67) баллов из 40 возможных (таблица 2).
Таблица 2. Интенсивность симптомов на Визите 1
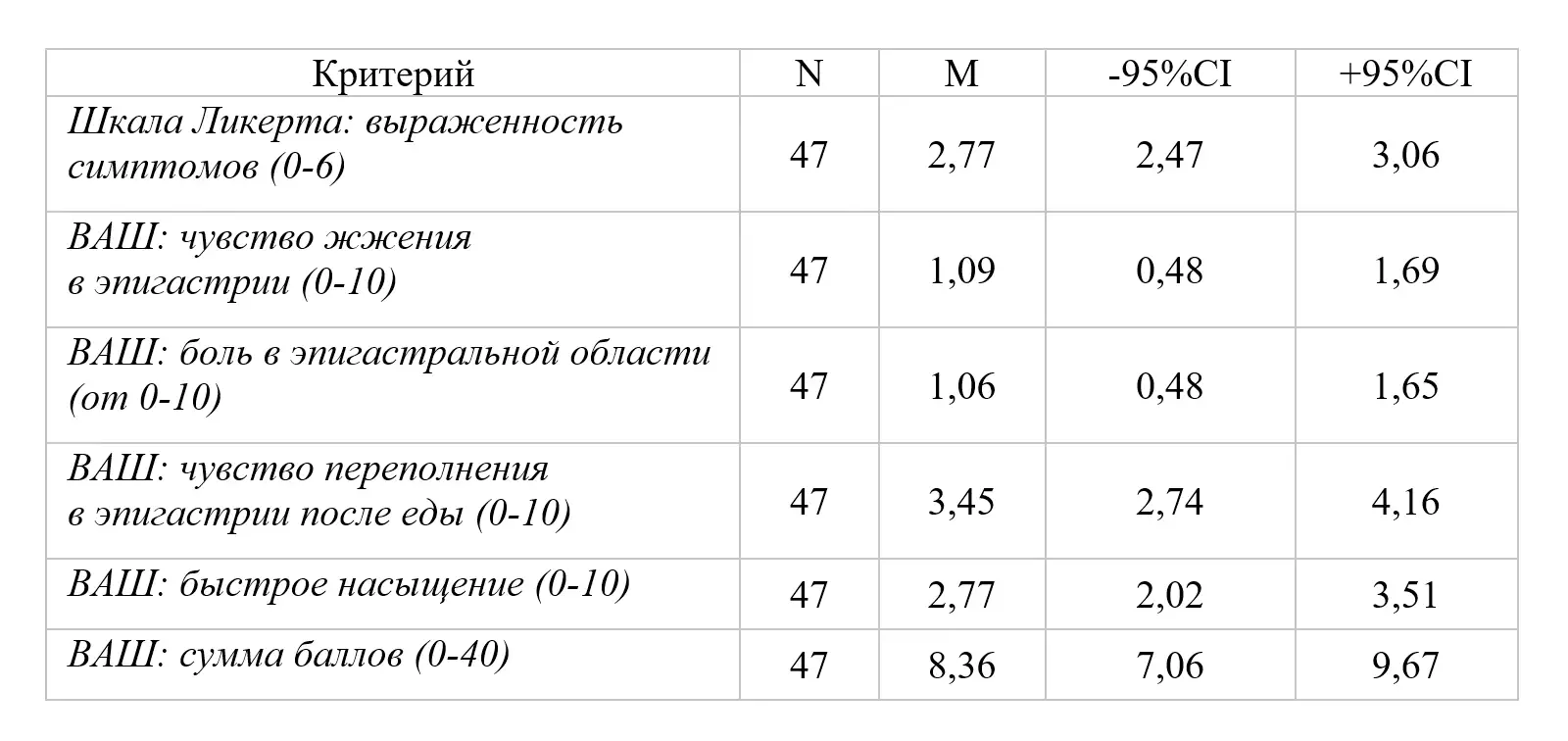
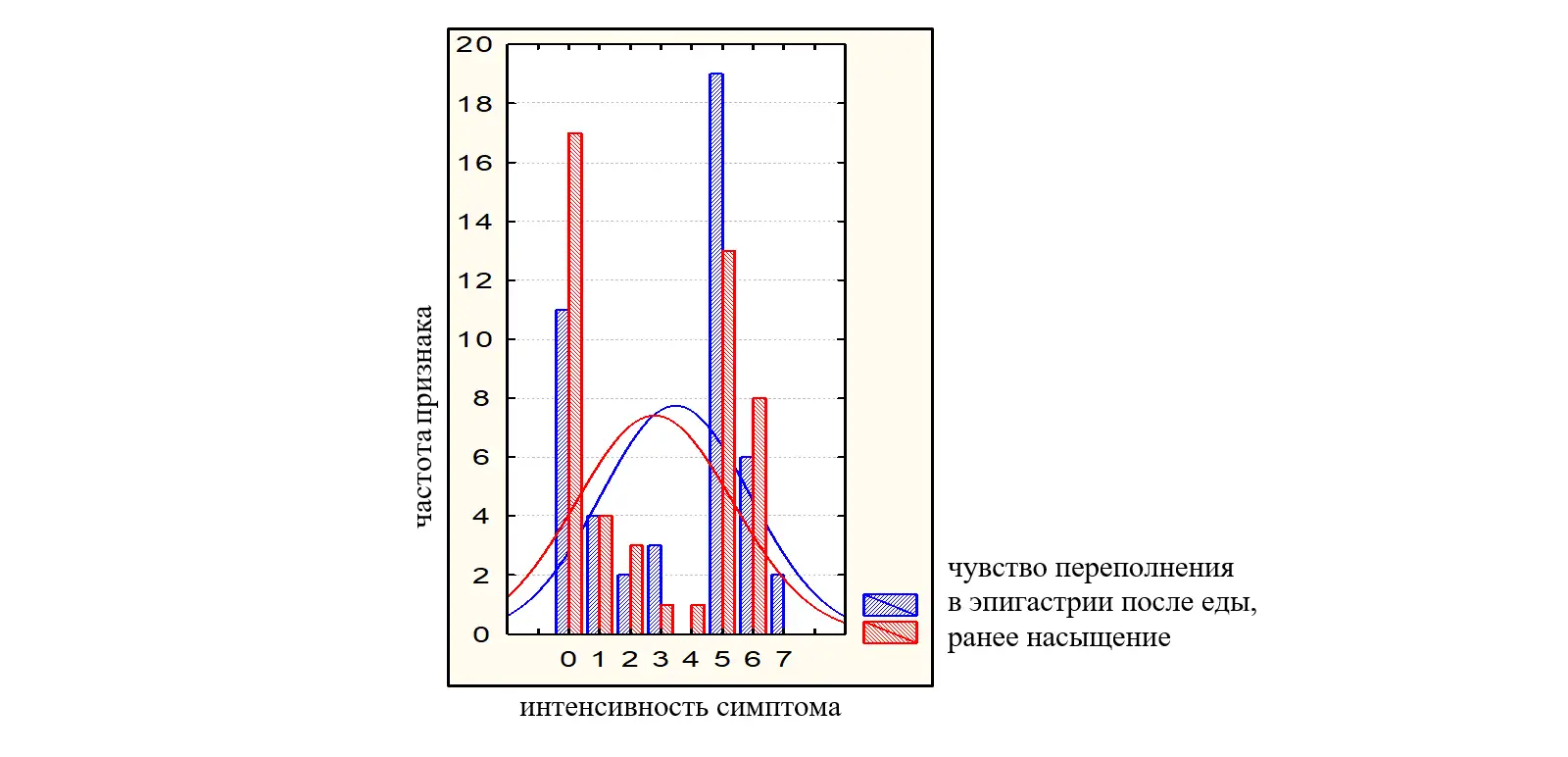
Интенсивность симптомов по 10-бальной шкале была от слабой до умеренно выраженной и составила: переполнение в эпигастрии после еды – 3,45(2,74-4,16) балла; раннее насыщение – 2,77(2,02-3,51) балла; чувство жжения в эпигастрии 1,09 (0,48-1,69) балла, боль в эпигастральной области – 1,06(0,48-1,65) балла. Пациенты имели более выраженные проявления постпрандиального дистресс-синдрома (переполнение в эпигастрии после еды; раннее насыщение – 3,45(2,74-4,16) балла и 2,77(2,02-3,51) балла соответственно в сравнении с симптомами эпигастральной боли (чувство жжения в эпигастрии; боль в эпигастральной области 1,09 (0,48-1,69) балла; 1,06(0,48-1,65) балла (во всех случаяхр<0,05). На рисунках 2 и 3 представлено распределение больных в зависимости от интенсивности симптомов ФД по ВАШ (0-10).
Рисунок 2. Распределение больных с СЭБ в зависимости от интенсивности симптомов (0-10 баллов по ВАШ).
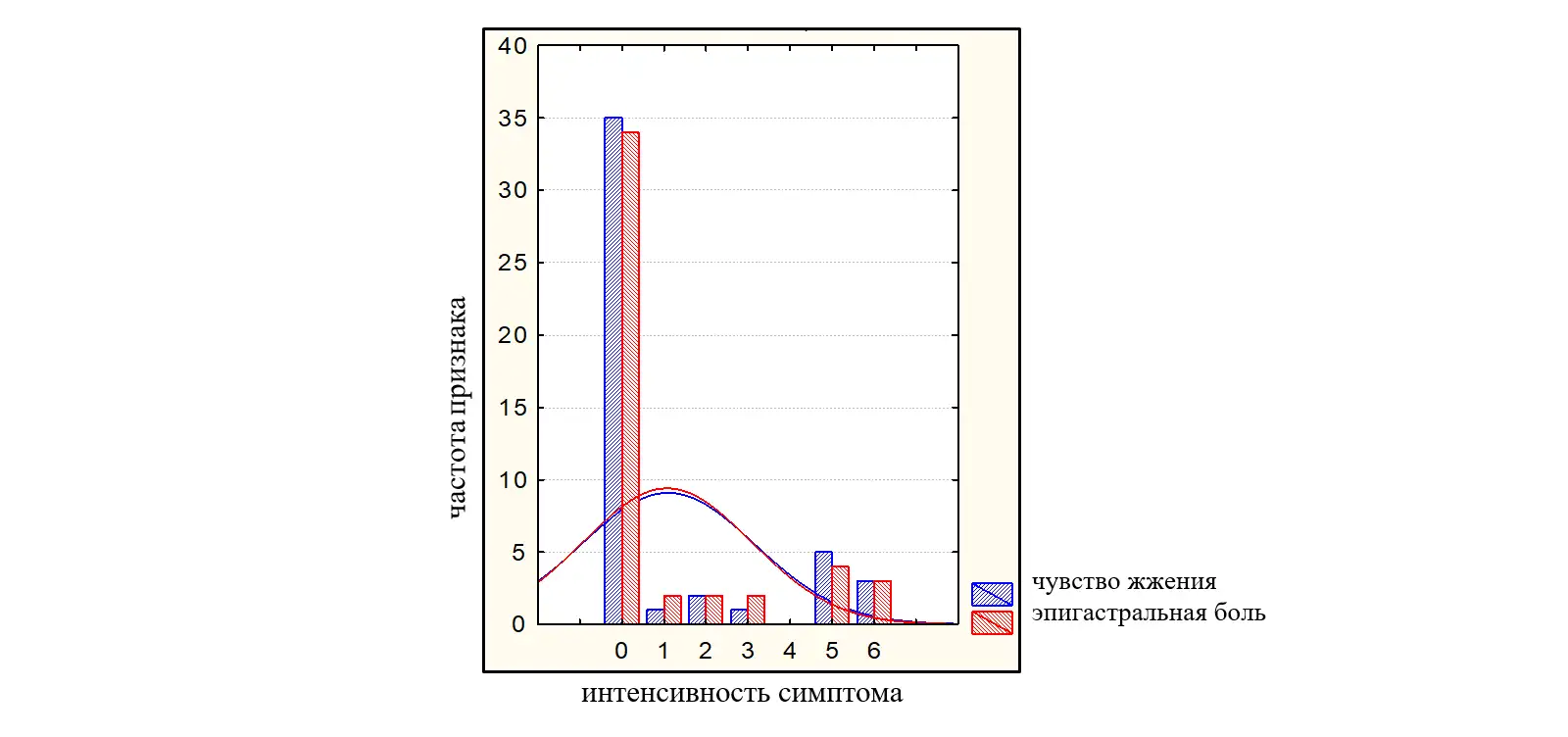
Рисунок 3. Распределение больных с ППДС в зависимости от интенсивности симптомов (0-10 баллов по ВАШ).
Через 4 недели от момента начала терапии препаратом Омез® ДСР (Визит 2) при измерении каждого симптома по шкале Ликерта и по 10-сантиметровой ВАШ зарегистрировано статистически значимое изменение суммы баллов по интенсивности 4 основных симптомов ФД (чувство жжения в эпигастральной области, боль в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения), выраженности проявления ППДС и синдрома эпигастральной боли. Положительная динамика в виде полного купирования симптомов (0 баллов по 10-сантиметровой ВАШ; 0 баллов по шкале Ликерта) отмечена у всех 47 пациентов (р<0,0001; р<0,0001).
Анализ вторичных конечных точек.
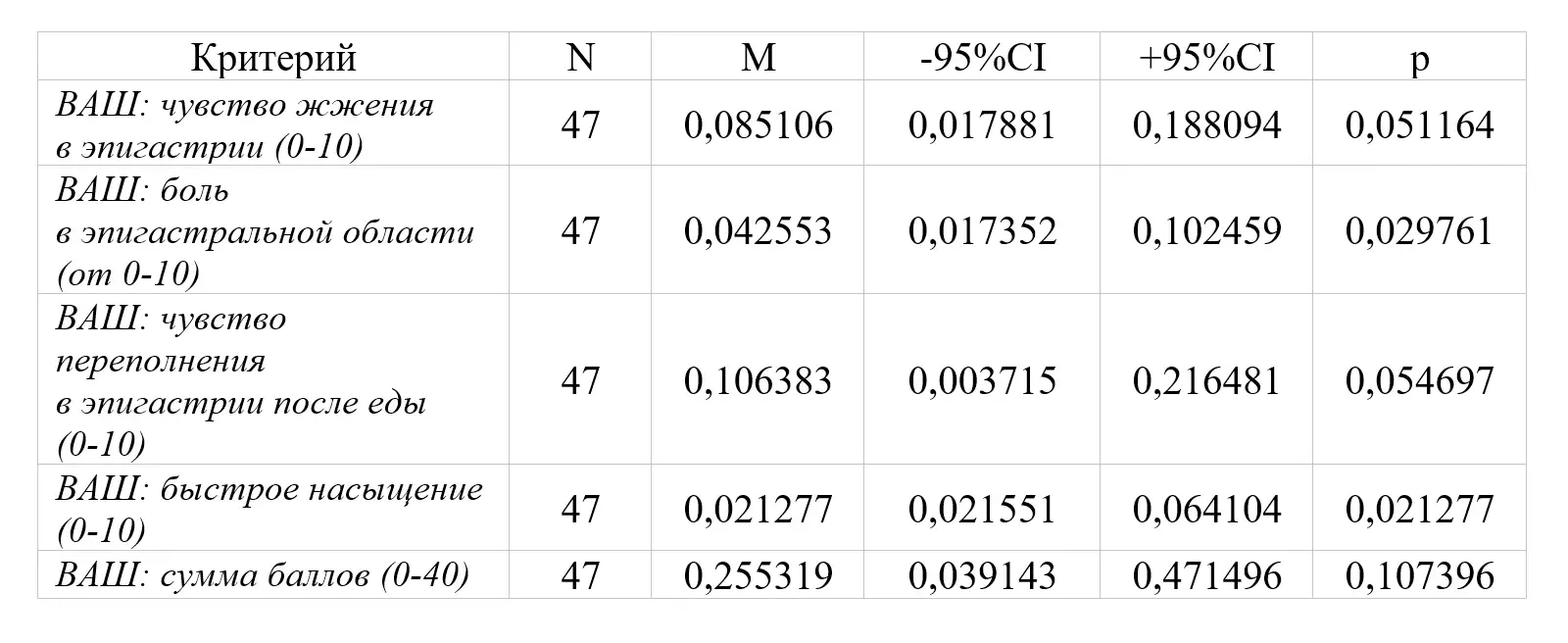
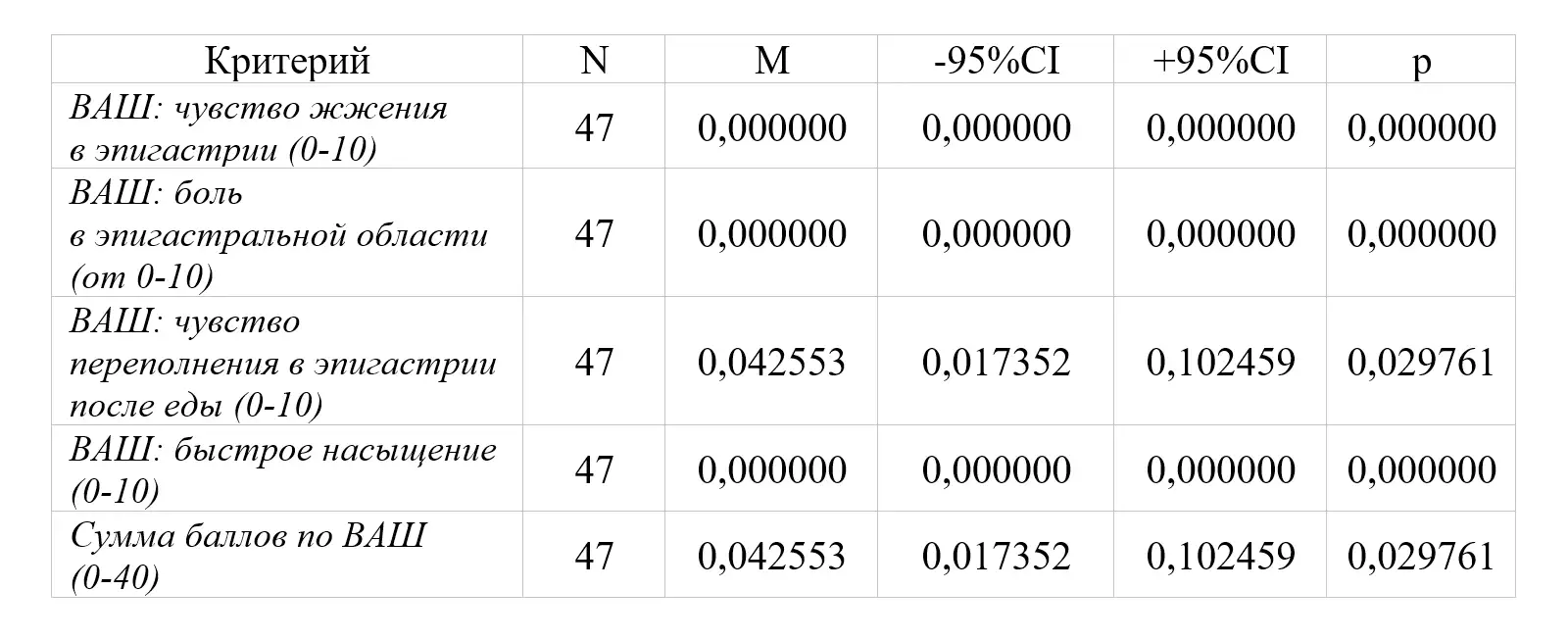
Через 4 недели (Визит 2) доля пациентов, у которых выраженность основных симптомов функциональной диспепсии по отдельности (боль в эпигастральной области, чувство жжения в эпигастральной области, чувство переполнения в эпигастральной области после приема пищи, чувство быстрого насыщения) за последние 24 ч на фоне проводимого лечения уменьшилась более чем на ≥ 50% при измерении по 10-сантиметровой ВАШ к Визиту 2 по сравнению со значением, полученным на скрининге и составила 100% (р<0,0001).
Доля пациентов, у которых к Визиту 2 полностью купировались симптомы боли в эпигастральной области и/или дискомфорта в эпигастральной области (0 баллов по 7-балльной шкале Ликерта) составила 100% (р<0,0001).
Выраженность боли в эпигастральной области и чувства жжения в эпигастральной области по 10-балльной числовой шкале ВАШ (по данным дневника пациента) к Визиту 2 по сравнению со значениями, полученным на скрининге составила 0 баллов для обоих симптомов (р<0,0001; р<0,0001).
Выраженность чувства переполнения в эпигастральной области и чувства быстрого насыщения после приема пищи по 10-балльной числовой шкале ВАШ (по данным дневника пациента) к Визиту 2 по сравнению со значением, полученным на скрининге составила 0 баллов для обоих симптомов (р<0,0001; р<0,0001).
Глобальная оценка исследователем эффективности терапии на Визите 2 по 5-балльной шкале Ликерта соответствовала очень хорошей у 47 (100%) пациентов.
Исследователи оценили так же переносимость лечения Омез ДСР, как очень хорошую.
Общая оценка удовлетворенности лечением пациентом по 5-балльной шкале Ликерта согласно данным анкетирования показала, что 47 (100%) пациентов отмечали «полное удовлетворение лечением» в изучаемый период.
Оценка эффективности лечения пациентом по 7-балльной шкале Ликера: показала, что 47 (100%) пациентов отмечали «значительное улучшение проведенного лечения» в изучаемый период.
По результатам телефонного контакта на 35±2 день исследования все пациенты, завершившие исследование, отмечали наличие стойкого клинического эффекта, в связи с чем, данные, дублирующие Визит 2 не приводятся.
В течение всего периода лечения проводился контроль комплаентности, случаев пропуска в приеме препарата не отмечено.
Дополнительных препаратов для купирования симптомов в первые дни терапии не требовалось.
Дополнительно в ходе исследования были получены данные, которые позволили оценить сроки достижения терапевтического эффекта препарата Омез® ДСР и стабильность полученного эффекта.
При анализе дневников пациентов через 3 дня от начала терапии положительная динамика в виде полного отсутствия симптомов отмечена у 41 больного (87,23%), симптомы сохранялись у 6 (12,77%) больных. Иинтенсивность симптомов составила по 10-сантиметровой шкале ВАШ (сумма всех симптомов) - 0,26 (0,04-0,47) балла, в сравнении с Визитом 1, различия статистически значимы (р<0,05) при анализе симптомов по ВАШ для синдрома боли в эпигастрии, быстрого насыщения (таблица 3).
Таблица 3. Динамика симптомов через три дня от начала лечения
На 14 день лечения симптомы полностью были купированы у 95,74% больных (N =45). У 2 (4,26%) пациентов сохранялись симптомы в виде проявлений ППДС (N=1) и ЭБ (N=1) легкой степени. По 10-сантиметровой шкале ВАШ интенсивность симптомов составила 0,043(0,02-0,10) балла в сравнении с Визитом 1 8,36 (7,06-9,67) балла, различия статистически значимы по всем исследуемым параметрам (таблица 3).
Таблица 4. Динамика симптомов через 14 дней от начала лечения
На 30±2 день от начала терапии (Визит 2) полный эффект от проводимой терапии отмечен у 100% (47) пациентов р<0,0001 (рисунок 4).
Рисунок 4. Динамика симптомов по шкале ВАШ (0-3-14-30±2 день)
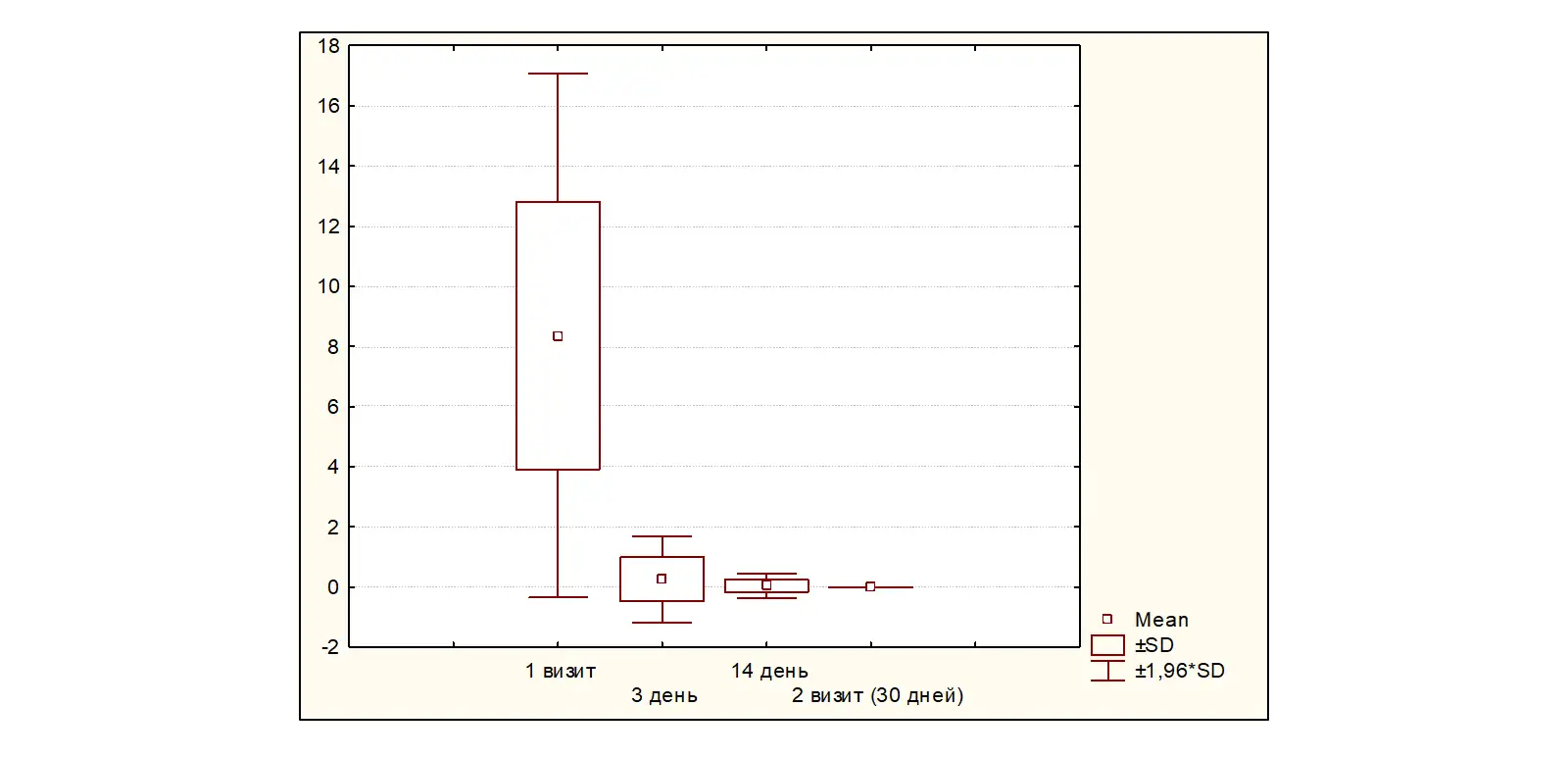
Таким образом, достижение стойкого эффекта купирования симптомов ФД наблюдается на 3 день от начала терапии у 87,23% больных, на 14 день лечения - у 95,64%, полное купирование симптомов отмечено у всех больных на 30±2 день терапии.
Оценка переносимости терапии.
В рамках оценки переносимости терапии проведен анализ нежелательных явлений. Нежелательных явлений в ходе исследования не было отмечено.
Переносимость препарата в ходе исследования была оценена врачом как очень хорошая у 95%, хорошая – у 5%. Согласно расчетам, корригированная величина интервала QT на исходном и финальном визитах находится в пределах нормы (норма от 350 до 460 мс).
Обсуждение полученных результатов.
Диспепсия включает один или несколько симптомов в различных сочетаниях: боль и чувство жжения в эпигастрии, чувство переполнения в эпигастрии после еды, раннее насыщение, возможны тошнота, отрыжка [12,8]. В соответствии с ведущими проявлениями выделяют два субтипа диспепсии: постпрандиальный дистресс-синдром (ППДС) и синдром эпигастральной боли (СЭБ). ППДС возникает после еды, симптомы СЭБ появляются независимо от приема пищи, при этом оба синдрома могут выявляться одновременно [13].
Исследование показало, что у 40,43% пациентов заболевание протекало в виде перекреста ППДС и СЭБ. Полученные результаты согласуются с литературными данными. Частота сочетания ППДС и СЭБ в популяциях варьирует от 1,5 до 64% [13,14].
Первичная медико-санитарная помощь остается первой точкой контакта для пациентов с диспепсией и многие из них будут лечиться и наблюдаться только в этих условиях. Роль терапевта состоит в том, чтобы выявить признаки ФД, назначить эффективную терапию и обеспечить своевременный контроль за лечением. Было проведено несколько РКИ, сравнивающих эти различные стратегии лечения. У пациентов с ФД и отрицательным результатом теста на H. pylori предлагается несколько классов препаратов, которые могут быть полезными.[15,16].
Мы провели исследование, целью которого было оценить эффективность применения комбинированной терапии ИПП и прокинетиком (препарат Омез® ДСР) у пациентов с ФД и хроническим Нр-негативным гастритом через 4 недели от момента начала терапии.
Исследование продемонстрировало высокую эффективность в виде полного купирования симптомов у всех пациентов, как у больных с наличием изолированных вариантов ФД (ППДС или СЭБ), так и при наличии перекреста симптомов.
Фиксированная комбинация препаратов, принадлежащих разным классам (ИПП + прокинетик), демонстрирует хороший клинический эффект и высокий уровень переносимость такой терапии, и должна рассматриваться в качестве препаратов I линии в лечении больных с хроническим Helicobacter pylori ‒ негативным гастритом.
Полученные результаты подтверждают факт, что несмотря на многофакторность патофизиологических механизмов ФД, нарушения гастродуоденальной моторики (замедленное опорожнение желудка, нарушение желудочной аккомодации), желудочная и дуоденальная гиперчувствительность являются релевантными в патогенезе заболевания [17].
Ингибиторы протонного насоса дозозависимым образом угнетают базальную и стимулированную секрецию соляной кислоты в желудке путем ингибирования Н+/К+-аденозинтрифосфатазы (АТФазы) [18]. Наиболее широко известный и изученный препарат из группы ингибиторов протонной помпы – омепразол, который в настоящее время считается стандартом в лечении кислотозависимых заболеваний. Он прошел многочисленные клинические испытания, отвечающие критериям доказательной медицины, а его эффективность определяется как эталон антисекреторного ответа [19].
Опубликованные мета-анализы по оценке применения прокинетиков с разными механизмами действия в лечении больных ФД [20] демонстрируют лучшую эффективность домперидона в сравнении с другими прокинетическими препаратами [21].
На сегодняшний день опубликовано несколько метаанализов по оценке эффективности совместного применения ИПП и прокинетиков при ФД.
15 РКИ с участием 5389 пациентов с ФД любого подтипа, в которых сравнивали терапию ИПП с плацебо оценили Relative risk reduction (RRR), показатель, отражающий насколько лечение снизило риск неблагоприятных исходов по сравнению с контрольной группой, не получавшей лечения для ИПП ‒ 0,83 (95% ДИ, 0,77–0,89), для прокинетиков ‒ 0,92 (95% ДИ, 0,88–0,97). Количество пролеченных пациентов для получения эффекта от ИПП (number needed to treat, NNT) ‒ 8 (95% ДИ, 6–14), для прокинетиков ‒ 12,5 (95% ДИ, 8–25) [22].
Комбинация ИПП с прокинетиком превосходит монотерапию каждого из них в отдельности. Ранее проведенные исследования показали высокую эффективность фиксированной комбинации омепразол-домперидон (препарат Омез® ДСР), по сравнению с монотерапией в обеспечении полного купирования симптомов рефлюкса и заживления эзофагита у пациентов с гастроэзофагеальной рефлюксной болезнью.
Полученные результаты согласуются с особенностями фармакокинетических характеристик компонентов, входящих в состав препарата Омез® ДСР [9]. Комбинация двух действующих веществ оказывает комплексное действие на основные звенья патогенеза диспепсических нарушений различного генеза. Домперидон усиливает и синхронизирует физиологические перистальтические волны, омепразол снижает базальную и стимулированную секрецию соляной кислоты. Помимо этого, омепразол уменьшает активность кислотно-пептического фактора и потенцирует эффект прокинетика. Снижение кислотности желудочного сока уменьшает абсорбцию домперидона и кислотосупрессивный эффект омепразола в составе Омез ДСР способствует большей продолжительности действия домперидона за счет замедления его всасывания в желудке [26].
Одним из дискутируемых аспектов длительной терапии прокинетиками является влияние класса препаратов на интервал QTc, риски желудочковых аритмий и внезапной сердечной смерти. И несмотря на несомненные клинические эффекты прокинетиков в лечении ФД, длительное применение в настоящее время является предметом изучения из-за возможностей риска тяжелой желудочковой аритмии.
Проблемы безопасности домперидона стали обсуждаться с 1980-х годов, когда было сообщено о нескольких серьезных сердечных событиях [27-30]. С тех пор домперидон для внутривенного введения был изъят из продажи с ограниченным использованием домперидона для приема внутрь из-за возможной связи с кардиотоксичностью [31-35].
Однако в 2020 году были опубликовано исследование с участием 918 пациентов, которым были назначены все три прокинетика, тяжелые желудочковые аритмии наблюдалась в 765 случаях в течение 8332 человеко-лет без воздействия, 36 случаев в течение 397,73 человеко-лет лечения домперидоном, 57 случаев в течение 384,1 человеко-года мосаприда, периоды воздействия и 60 случаев в течение 354,4 человеко-лет периодов воздействия итоприда. Выводы, которые опубликовали исследователи: воздействие домперидона не было связано с повышенным риском тяжелых желудочковых нарушений ритма: 0,948 (0,672-1,338), p = 0,762), тогда как воздействие мозаприда и итоприда было связано с повышенным риском желудочковых аритмий. После поправки на модифицируемые факторы (возраст, пол и сопутствующие заболевания) эти ассоциации остались неизменными [36].
В 2019 году опубликованы результаты исследования, целью которого было определить влияние и безопасность домперидона на интервал QTc в обычно назначаемых дозах от 30 до 80 мг в день у больных с гастропарезом. В исследовании проанализированы пациенты, принимавшие домперидон для лечения гастропареза в период с января 2012 года по сентябрь 2017 года в одном центре. В этом исследовании рассматривались ЭКГ, прежде всего интервал QTc исходно, через 2–6 месяцев после начала лечения домперидоном, через 6–12 месяцев после начала и через ≥12 месяцев после начала. Первичной конечной точкой было удлинение интервала QTc > 500 мс. Вторичными конечными точками были QTc > 450 мс для мужчин, QTc> 470 мс для женщин, удлинение QTc ≥20 мс выше исходного уровня и удлинение QTc > 60 мс выше исходного уровня. Для анализа были использованы данные 246 пациентов (возраст 46,3±17,4 года). ЭКГ были доступны для всех 246 пациентов до лечения, 170 пациентов через 2–6 месяцев, 135 пациентов через 6–12 месяцев и 152 пациентов по крайней мере через 1 год после начала лечения домперидоном. Из 246 пациентов у 15 пациентов (6,1%, 9 женщин) клинически значимое удлинение интервала QTc; 11 имели QTc> 450 мс для мужчин или> 470 мс для женщин; ни у кого не было удлинения интервала QTc > 500 мс; 5 (2,0%) имели > 60 мс по сравнению с исходным уровнем, а 61 (24,7%) пациент имел увеличение QTc ≥20 мс, но <60 мс по сравнению с исходным уровнем. Исследование показало, что Домперидон в традиционно используемых дозах для лечения гастропареза (от 30 до 80 мг/сут) вызывал удлинение интервала QTc только у 6% пациентов, при этом интервал QT не достигал значения, которое считается клинически значимым. Эти данные свидетельствуют о том, что домперидон можно безопасно назначать в дозах от 30 до 80 мг в день для лечения гастропареза [37].
Наше исследование показало, что препарат Омез® ДСР (фиксированная лекарственная комбинация домперидона с омепразолом, в которой прокинетик представлен формой модифицированного высвобождения) обладает хорошим профилем безопасности, его применение не сопровождается клинически значимым удлинением интервала OTc.
Фиксированная лекарственная комбинация домперидона с омепразолом (Омез® ДСР) обеспечивает равномерное поступление действующего вещества в системный кровоток без развития высоких «пиковых» концентраций, сопряженных с повышенным риском дозозависимых нежелательных лекарственных реакций.
С помощью MUPs формы производители также решили и проблему возможного отрицательного взаимодействия антисекреторного препарата с прокинетиком. В предложенной комбинации домперидон достигает максимальных концентраций в крови через 30–60 мин, т.е. в то время, когда омепразол только начинает всасываться в кишечнике (30 мин) [38].
Открытый дизайн, отсутствие группы контроля, небольшой размер выборки ‒ вот некоторые ограничения проведенного исследования.
Заключение и выводы.
___________
Литература
1. British Society of Gastroenterology guidelines on the management of functional dyspepsia / Christopher J Black , Peter A Paine, Anurag Agrawal, Imran Aziz, Maria P Eugenicos, Lesley A Houghton, Pali Hungin, Ross Overshott, Dipesh H Vasant, Sheryl Rudd, Richard C Winning, Maura Corsetti, Alexander C Ford// Gut: first published as 10.1136/gutjnl-2022-327737 on 7 July 2022
2. Ивашкин В.Т., Маев И.В., Шептулин А.А. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению функциональной диспепсии. Рос журн гастроэнтерол гепатол колопроктол 2017; 27(1):50–61
3. Jones R. Primary care research and clinical practice: gastroenterology. Postgrad Med J 2008;84:454–8.doi:10.1136/pgmj.2008.068361 pmid:http://www.ncbi.nlm.nih.gov/pubmed/18940946
4. Sperber A.D., Bangdiwala S.I., Drossman. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation global study. Gastroenterology 2021;160:99–114.doi:10.1053/j.gastro.2020.04.014
5. Sperber A.D., Bangdiwala S.I., Drossman. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation global study. Gastroenterology 2021;160:99–114.doi:10.1053/j.gastro.2020.04.014
6. Rahman M.M., Ghoshal U.C., Kibria M.G., et al. Functional dyspepsia, peptic ulcer, and Helicobacter pylori infection in a rural community of South Asia: An endoscopy-assisted household survey. Clin Transl Gastroenterol 2021;12:e00334.doi:10.14309/ctg.
7. Rahman M.M., Ghoshal U.C., Kibria M.G., et al. Functional dyspepsia, peptic ulcer, and Helicobacter pylori infection in a rural community of South Asia: An endoscopy-assisted household survey. Clin Transl Gastroenterol 2021;12:e00334.doi:10.14309/ctg.
8. Drossman D.A. Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV. Gastroenterology. 2016;150:1262-1279.e2. https://doi.org/10.1053/j.gastro.2016.02.032
9. Инструкция по медицинскому применению Омез ДСР https://grls.rosminzdrav.ru/, дата обращения 05.12.22.
10. Bolling-Sternevald E, Lauritsen K, Aalykke C, Havelund T, Knudsen T, Unge P, et al. Effect of Profound Acid Suppression in Functional Dyspepsia: a Double-Blind, Randomized, Placebo-Controlled Trial. Scandinavian Journal of Gastroenterology. 2002 Jan 1;37(12):1395–402
11. Tominaga K. Double-blind Trial With Rikkunshito Versus Placebo on Efficacy and Safety in Patients With Functional Dyspepsia: Multi-center Study (DREAM Study) [Internet]. clinicaltrials.gov; 2017 Jul [cited 2022 May 1
12. Лазебник Л.Б. Рекомендации по ведению первичных пациентов с симптомами диспепсии. Экспериментальная и клиническая гастроэнтерология. 2018;5(153):4-18.]
13. Matsuzaki J, Suzuki H, Asakura K. Classification of functional dyspepsia based on concomitant bowel symptoms. Neurogastroenterology & Motility. 2012;24:325-e164. https://doi.org/10.1111/j.1365-2982.2011.01859 .
14. Ghoshal UC, Singh R. Frequency and risk factors of functional gastro-intestinal disorders in a rural Indian population. J Gastroenterol Hepatol. 2017;32:378-387
15. Samsom M, Verhagen MA , vanBerge Henegouwen GP , et al. Abnormal clearance of exogenous acid and increased acid sensitivity of the proximal duodenum in dyspeptic patients. Gastroenterology 1999;116:515–20.doi:10.1016/s0016-5085(99)70171-x
16. Ford AC , Moayyedi P , Black CJ , et al. Systematic review and network meta-analysis: efficacy of drugs for functional dyspepsia. Aliment Pharmacol Ther 2021;53:8–21.doi:10.1111/apt.16072
17. Stanghellini V, Chan FK, Hasler WL, Malagelada JR, Suzuki H, Tack J, et al. Gastroduodenal disorders. Gastroenterology 2016;150:1380‐92.
18. Sachs G. Proton pump inhibitors and acid-related diseases. Pharmacotherapy. 1997;17(1):22–37. Available at: https://www.ncbi.nlm.nih.gov/pubmed/9017763.
19. Минушкин О.Н., Масловский Л.В. Омепразол в терапии кислотозависимых заболеваний. Медицинский совет. 2015;(3):8-13. doi: 10.21518/2079-701X-2015-13-8-13
20. Hiyama T, Yoshihara M, Matsuo K, Kusunoki H, Kamada T, Ito M, et al. Treatment of functional dyspepsia with serotonin agonists: a meta-analysis of randomized controlled trials. J Gastroenterol Hepatol. 2007;22(10):1566–70. doi: 10.1111/j.1440-1746.2006.04723.x. [PubMed] [CrossRef] [Google Scholar].
21. Yang YJ, Bang CS, Baik GH, Park TY, Shin SP, Suk KT, Kim DJ. Prokinetics for the treatment of functional dyspepsia: Bayesian network meta-analysis. BMC Gastroenterol. 2017 Jun 26;17(1):83. doi: 10.1186/s12876-017-0639-0. PMID: 28651565; PMCID: PMC5485548.
22. Bollegala N.P.,Khanna R., Moayyedi P.et al. Prokinetics for functional dyspepsia (Protocol) Cochrane Database Syst Rev. 2011; 11: CD009431
23. Pittayanon R, Yuan Y, Bollegala NP, Khanna R, Leontiadis GI, Moayyedi P. Prokinetics for functional dyspepsia. Cochrane Database Syst Rev. 2018 Oct 18;10(10):CD009431. doi: 10.1002/14651858.CD009431.pub3. PMID: 30335201; PMCID: PMC6516965.
24. Аng Y.J., Bang C.S., Baik G.H. et al. Prokinetics for the treatment of functional dyspepsia: Bayesian network meta- analysis // BMC Gastroenterol. — 2017 Jun 26. — 17(1). — 83
25. Marakhouski KY, Karaseva GA, Ulasivich DN, Marakhouski YK. Omeprazole-Domperidone Fixed Dose Combination vs Omeprazole Monotherapy: A Phase 4, Open-Label, Comparative, Parallel Randomized Controlled Study in Mild to Moderate Gastroesophageal Reflux Disease. Clin Med Insights Gastroenterol. 2017 May 31;10:1179552217709456. doi: 10.1177/1179552217709456. PMID: 28607547; PMCID: PMC5457029
26. Zamani, N.F.; Sjahid, A.S.; Tuan Kamauzaman, T.H.; Lee, Y.Y.; Islam, M.A. Efficacy and Safety of Domperidone in Combination with Proton Pump Inhibitors in Gastroesophageal Reflux Disease: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. J. Clin. Med. 2022, 11, 5268. https://doi.org/10.3390/ jcm11185268
27. Giaccone, G., Bertetto, O. & Calciati, A. Two sudden deaths during prophylactic antiemetic treatment with high doses of domperidone and methylprednisolone. Lancet 2, 1336–1337. https://doi.org/10.1016/s0140-6736(84)90841-9 (1984).
28. Google Scholar. Joss, R.A., Goldhirsch, A., Brunner, K.W. & Galeazzi, R.L. Sudden death in cancer patient on high-dose domperidone. Lancet 1, 1019. https://doi.org/10.1016/s0140-6736(82)92016-5 (1982).
29. Osborne, R.J., Slevin, M.L., Hunter, R.W. & Hamer, J. Cardiotoxicity of intravenous domperidone. Lancet 2, 385. https://doi.org/10.1016/s0140-6736(85)92515-2 (1985).
30. Roussak, J.B., Carey, P. & Parry, H. Cardiac arrest after treatment with intravenous domperidone. Br. Med. J. (Clin. Res. Ed) 289, 1579, https://doi.org/10.1136/bmj.289.6458.1579 (1984).
31. Arana, A. et al. Risk of out-of-hospital sudden cardiac death in users of domperidone, proton pump inhibitors, or metoclopramide: A population-based nested case-control study. Drug Saf. 38, 1187–1199. https://doi.org/10.1007/s40264-015-0338-0 (2015).
32. Straus, S.M. et al. Non-cardiac QTc-prolonging drugs and the risk of sudden cardiac death. Eur. Heart J. 26, 2007–2012. https://doi.org/10.1093/eurheartj/ehi312 (2005).
33. van Noord, C., Dieleman, J. P., van Herpen, G., Verhamme, K. & Sturkenboom, M. C. Domperidone and ventricular arrhythmia or sudden cardiac death: A population-based case-control study in the Netherlands. Drug Saf. 33, 1003–1014. https://doi.org/10.2165/11536840-000000000-00000 (2010).
34. Chen, H.L. & Hsiao, F.Y. Domperidone, cytochrome P450 3A4 isoenzyme inhibitors and ventricular arrhythmia: A nationwide case-crossover study. Pharmacoepidemiol. Drug Saf. 24, 841–848. https://doi.org/10.1002/pds.3814 (2015).
35. Johannes, C. B., Varas-Lorenzo, C., McQuay, L.J., Midkiff, K.D. & Fife, D. Risk of serious ventricular arrhythmia and sudden cardiac death in a cohort of users of domperidone: A nested case-control study. Pharmacoepidemiol. Drug Saf. 19, 881–888. https://doi.org/10.1002/pds.2016 (2010).
36. Song, B.G., Lee, Y.C., Min, Y.W. et al. Risk of domperidone induced severe ventricular arrhythmia. Sci Rep 10, 12158 (2020). https://doi.org/10.1038/s41598-020-69053-4
37. Field, Justin & Wasilewski, Melissa & Bhuta, Rajiv & Malik, Zubair & Cooper, Joshua & Parkman, Henry & Schey, Ron. (2019). Effect of Chronic Domperidone Use on QT Interval: A Large Single Center Study. Journal of Clinical Gastroenterology. Publish Ahead of Print. 1. 10.1097/MCG.0000000000001183.
38. Карева Е.Н., Сереброва С.Ю. Медикаментозное лечение нарушений моторики желудка – проблемы, пути решения, достижения. Экспериментальная и клиническая гастроэнтерология. 2017;(7):167-183. Режим доступа: http://nogr.org/images/Article/2017/G_07_2017_In-21_167-183
Медицинский совет. 2022; 16(23):181–190.
Лялюкова Елена Александровна, д.м.н., профессор кафедры внутренних болезней и семейной медицины, Омский государственный медицинский университет
Комментарии (0)