Категории
Сменить пароль!
Сброс пароля!


Компания Dr. Reddy’s зарегистрировала в России лекарственный препарат Диспевикт®(МНН акотиамид).
Это первый прокинетик с действующем веществом Акотиамид на российском рынке, препарат показан к применению при функциональной диспепсии у взрослых в возрасте от 18 лет.
Препарат станет доступен в аптеках с сентября 2023 года и будет отпускаться по рецепту.
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Диспевикт, 100 мг, таблетки, покрытые пленочной оболочкой
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: акотиамид.
Каждая таблетка, покрытая пленочной оболочкой, содержит 100 мг акотиамида (в виде акотиамида гидрохлорида гидрата).
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: лактозы моногидрат – 27 мг (см. раздел 4.4).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Таблетки, покрытые пленочной оболочкой.
Круглые таблетки, покрытые пленочной оболочкой белого или почти белого цвета, с гравировкой «100» на одной стороне и гладкие на другой. На поперечном срезе – ядро от белого до светло-желтого цвета.
4. КЛИНИЧЕСКИЕ ДАННЫЕ
4.1. Показания к применению
Препарат Диспевикт показан к применению у взрослых в возрасте от 18 лет при функциональной диспепсии для устранения следующих симптомов:
чувства переполнения в желудке после приема пищи,
вздутия верхней части живота,
чувства раннего насыщения.
4.2. Режим дозирования и способ применения
Режим дозирования
Препарат Диспевикт следует принимать по 1 таблетке (100 мг) 3 раза в сутки.
Если не наблюдается улучшение симптомов через 1 месяц после начала терапии акотиамидом, следует рассмотреть вопрос о прекращении его применения. Если симптомы диспепсии сохраняются, следует рассмотреть возможность наличия органического заболевания и, при необходимости, дополнительно к гастродуоденоскопии провести другие обследования.
Если отмечено стабильное улучшение симптомов, также следует рассмотреть вопрос о прекращении лечения. Не следует применять акотиамид в течение длительного периода времени без наблюдения врача.
Особые группы пациентов
Пациенты пожилого возраста
Акотиамид следует применять с осторожностью у пациентов пожилого возраста, у которых часто отмечается снижение функции почек и/или печени. При выявлении отклонений от нормы, следует принять соответствующие меры, например, приостановить применение акотиамида.
Дети
Безопасность и эффективность акотиамида у детей в возрасте от 0 до 18 лет на данный момент не установлены, Данные отсутствуют.
Способ применения
Внутрь, перед едой.
Таблетки следует проглатывать целиком, не разжевывая, запивая водой.
4.3. Противопоказания
Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, перечисленных в подразделе 6.1.
4.4. Особые указания и меры предосторожности при применении
Эффективность акотиамида при боли в эпигастральной области и изжоге при функциональной диспепсии не подтверждена.
Перед применением акотиамида необходимо исключить наличие органического поражения, в том числе злокачественного новообразования, такого как рак желудка.
У пациентов пожилого возраста, у которых часто отмечается снижение функции печени и/или почек, акотиамид следует применять с осторожностью.
Следует избегать одновременного применения акотиамида с другими холинергическими средствами.
Безопасность акотиамида при одновременном применении с другими прокинетическими средствами не установлена.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Следует проявлять осторожность при совместном приеме препарата Диспевикт:
с препаратами, обладающими антихолинергическим действием (атропин, бутилскопаломин): поскольку акотиамид оказывает ингибирующее действие на ацетилхолинэстеразу (АХЭ), при совместном применении с указанными препаратами эффект акотиамида снижается;
с М-холиномиметиками и ингибиторами АХЭ (ацетилхолин, неостигмин): поскольку М-холиномиметики, ингибиторы АХЭ и акотиамид обладают однонаправленным действием, при совместном применении будет усиливаться эффект как акотиамида, так и сопутствующих препаратов.
4.6. Фертильность, беременность и лактация
Беременность
Применение акотиамида во время беременности противопоказано (отсутствуют клинические данные о безопасности и эффективности его применения у беременных).
Лактация
Применение акотиамида в период грудного вскармливания противопоказано. В доклинических исследованиях установлено, что акотиамид проникает в грудное молоко.
Фертильность
Сведения о влиянии акотиамида на фертильность у человека отсутствуют. В доклинических исследованиях негативного влияния лекарственного средства на фертильность и общую репродуктивную функцию не выявлено.
4.7. Влияние на способность управлять транспортными средствами, механизмами
Исследования влияния акотиамида на способность управлять транспортными средствами и работать с механизмами не проводились. В период лечения следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
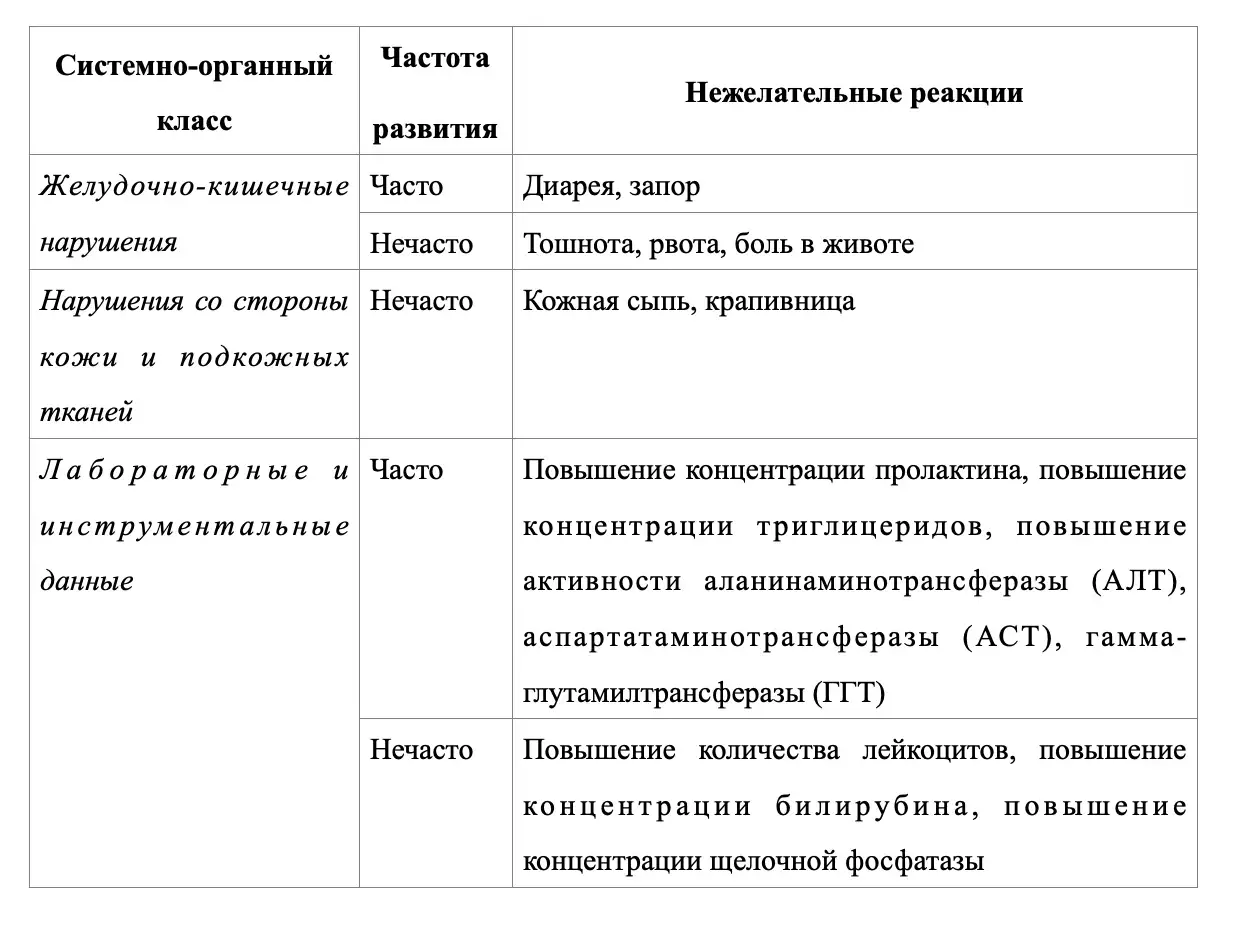
4.8. Нежелательные реакции
Табличное резюме нежелательных реакций
В клинических исследованиях акотиамида были выявлены следующие нежелательные реакции, оценка частоты которых проведена на основании следующих критериев: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (невозможно оценить на основании имеющихся данных).
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Российская Федерация
109012, г. Москва, Славянская площадь, д. 4, стр. 1
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Тел.: +7 800 550-99-03, +7 (499) 578-06-70
E-mail: pharm@roszdravnadzor.gov.ru
Республика Беларусь
220037, г. Минск, Товарищеский пер., 2а
УП «Центр экспертиз и испытаний в здравоохранении»
Тел.: +375-17-242-00-29
E-mail: rcpl@rceth.by
Республика Казахстан
010000, г. Астана, район Байконыр, ул. А.Иманова, 13 (БЦ «Нурсаулет 2»)
РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
Тел.: +7 (7172) 23-51-35
E-mail: farm@dari.kz
4.9. Передозировка
Симптомы
Случаев передозировки акотиамида не зарегистрировано. Максимальная суточная доза акотиамида в клинических исследованиях составляла 900 мг. На фоне приема акотиамида в этой дозе не отмечали неожиданных нежелательных реакций, а все выявленные нежелательные реакции были схожи по своей частоте и тяжести с наблюдаемыми у пациентов из группы плацебо. Последствия приема акотиамида в более высоких дозах неизвестны.
Лечение
Неспецифическое – отмена препарата, промывание желудка и симптоматическая терапия. Специфические антидоты отсутствуют.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: стимуляторы моторики ЖКТ.
Код АТХ: A03FA10
Механизм действия и фармакодинамические эффекты
Акотиамид демонстрировал ингибирование активности ацетилхолинэстеразы (in vitro) и усиление постпрандиальной моторики антральноrо отдела желудка у собак и крыс. Кроме того, препарат снижает выраженность индуцированного клонидином снижения моторики антральноrо отдела желудка у собак и крыс.
Показано, что акотиамид ускоряет замедленное опорожнение желудка, индуцированное клонидином у крыс.
Клиническая эффективность и безопасность
Продолжительность применения 4 недели
В рандомизированном двойном слепом плацебо-контролируемом исследовании фазы III оценивали эффективность акотиамида у пациентов с функциональной диспепсией. Пациенты принимали перорально ежедневно плацебо (n = 442) или акотиамид в дозе 100 мг (n = 450) 3 раза в сутки перед едой в течение 28 дней. После окончания приема акотиамида пациенты проходили период наблюдения продолжительностью еще 28 дней. Первичными конечными точками эффективности были «степень улучшения общего впечатления пациента в последний момент времени оценки во время лечения» и «степень устранения трех симптомов (чувство переполнения в желудке после приема пищи, вздутие живота и раннее насыщение) в момент времени последней оценки во время лечения». Если наблюдали статистически значимую разницу между показателями пациентов, принимавшими акотиамид в суточной дозе 300 мг, и пациентами, принимавшими плацебо, по обеим первичным конечным точкам, считали, что эффективность акотиамида превосходит эффективность плацебо.
Таблица 1. Показатели эффективности в последней временной точке после приема плацебо или акотиамида в суточной дозе 300 мг
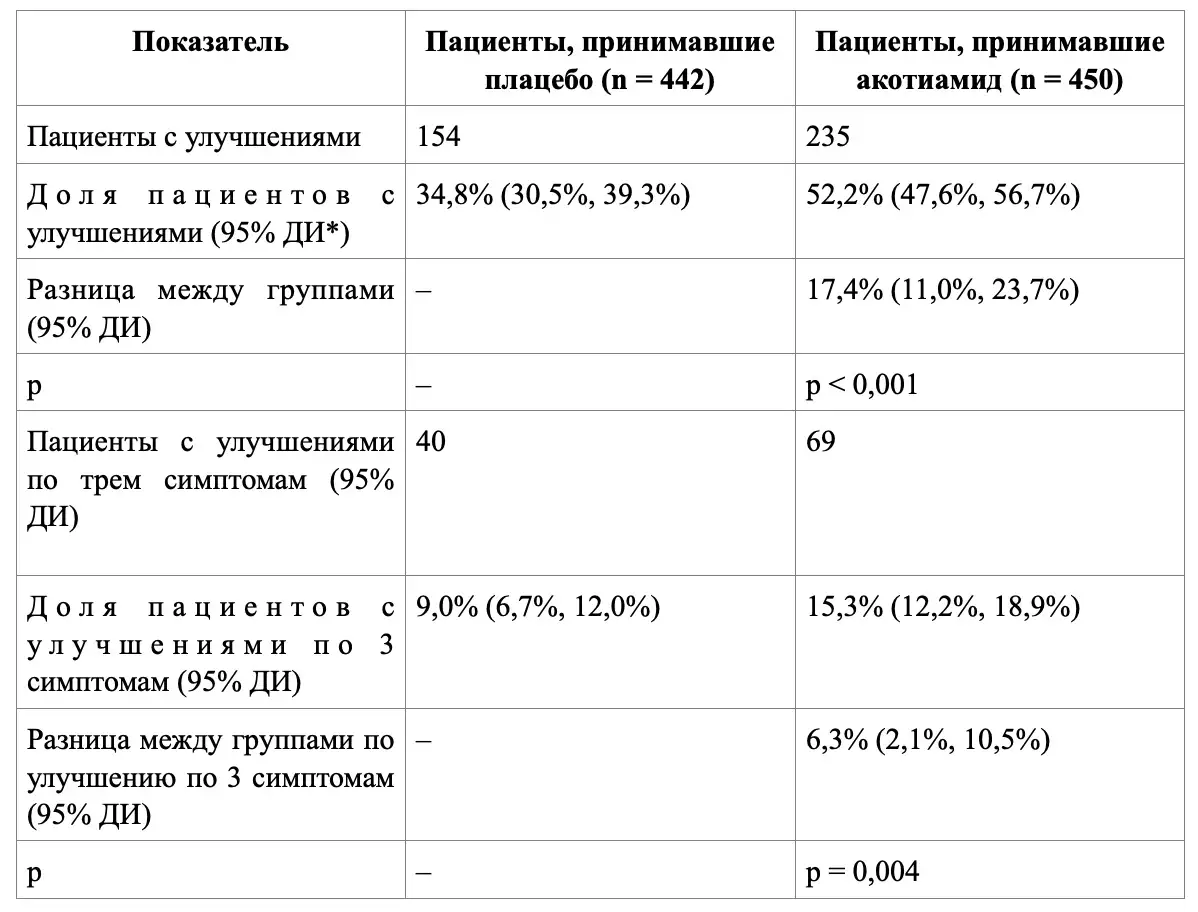
*ДИ – доверительный интервал.
Наблюдали статистически значимые различия между показателями пациентов, принимавших акотиамид в суточной дозе 300 мг, и показателями пациентов, принимавших плацебо, в обеих основных конечных точках (p < 0,001 и p = 0,004 соответственно; точный критерий Фишера, двусторонний уровень значимости 5%).
Продолжительность применения 28 недель
В исследовании долгосрочного применения, «частота улучшения по оценке участника» составляла 48,9 % (193 из 395 оставшихся участников) на 4-й неделе и 48,9 % (69 из 141 оставшегося участника) на 24-й неделе. Двадцать два из общего числа 405 пациентов продолжали получать препарат без перерыва до недели 24. Кроме того, 75,1 % (304/405 случаев) пациентов прекратили лечение, так как эффект был достигнут, среди них у 50,7 % (154/304 случаев) сохранялось облегчение симптомов в течение 12 недель, и прием данного препарата также был прекращен.
5.2. Фармакокинетические свойства
Абсорбция
Однократный прием
Фармакокинетические показатели после однократного приема внутрь 100 мг акотиамида: время достижения максимальной концентрации в сыворотке крови (tmax) составляет 2,42 ± 0,97 часов, максимальная концентрация в сыворотке крови (Cmax) – 30,82 ± 13,3 нг/мл, площадь под фармакокинетической кривой «концентрация – время» (AUC0-∞) – 171,3 ± 59,43 нг*ч/мл, период полувыведения (t1/2) – 13,31 ± 6,91 часов.
Многократное применение
После многократного приема внутрь 100 мг акотиамида по 1 таблетке 3 раза в сутки в течение 9 дней равновесная концентрация в плазме крови достигается, как правило, с третьей дозы, принятой на третий день. Кроме того, при многократном приеме его фармакокинетика не изменяется.
Влияние приема пищи на всасывание лекарственного препарата
В исследовании влияния приема пищи на фармакокинетику препарата установлено, что максимальное значение Сmax акотиамида достигается при приеме препарата перед едой, а минимальное – при приеме препарата после еды.
Распределение
Было показано, что степень связывания акотиамида с белками плазмы крови человека, измеренная in vitro методом равновесного диализа и составляющая приблизительно 84,21–85,95%, сопоставима со степенью связывания с человеческим сывороточным альбумином, составлявшей приблизительно 82,64–85,1%. Таким образом, основным связывающим акотиамид белком является альбумин.
Биотрансформация
После приема внутрь раствора радиоактивно меченого акотиамида (600 мг/103 мкКи) натощак 6 здоровыми взрослыми мужчинами, 60% от радиоактивности в плазме крови приходилось на долю неизмененного лекарственного средства.
При участии изоферментов цитохрома P450 (CYP) 2C8, 1A1 или 3A4 акотиамид метаболизируется до деизопропила. Кроме того, на основании анализа метаболизма in vitro с использованием системы экспрессии микросомального фермента уридиндифосфат-глюкуронилтрансферазы (UGT) человека, можно предположить, что лекарственный препарат метаболизируется до образования конъюгата неизмененного акотиамида с глюкуроновой кислотой при участии изоферментов UGT1A8 или UGT1A9.
Элиминация
Отмечено, что 92,7% от принятой дозы акотиамида выводится через кишечник и 5,3% выводится почками.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1. Перечень вспомогательных веществ
6.2. Несовместимость
Не применимо.
6.3. Срок годности (срок хранения)
3 года.
6.4. Особые меры предосторожности при хранении
Хранить при температуре не выше 25 °С.
6.5 Характер и содержание первичной упаковки
По 10 таблеток в контурной ячейковой упаковке из пленки поливинилхлоридной/поливинилиденхлоридной и фольги алюминиевой.
По 5 или 9 контурных ячейковых упаковок вместе с листкомвкладышем в пачке из картона.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Нет особых требований к утилизации.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
Индия
Д-р Редди’с Лабораторис Лтд. / Dr. Reddy’s Laboratories Ltd.
8-2-337, Роад № 3, Банжара Хиллс, Хайдерабад, Телангана-500034, Индия / 8-2-337, Road No. 3, Banjara Hills, Hyderabad, Telangana-500034, India
Тел.: +91 40 4900 2900
Факс: +91 40 4900 2999
E-mail: mail@drreddys.com
7.1. Представитель держателя регистрационного удостоверения на территории Союза
Претензии потребителей направлять по адресу:
Российская Федерация
Представительство фирмы «Д-р Редди’с Лабораторис Лтд.»
115035, г. Москва, Овчинниковская наб., д. 20, стр. 1
Тел.: +7 (495) 795-39-39
E-mail: adverse@drreddys.com
Республика Беларусь
Представительство компании «Д-р Редди’с Лабораторис Лимитед» (Республика Индия) в Республике Беларусь
220035, г. Минск, ул. Тимирязева, д. 72, офис 22, 53
Тел.: +375 17 336-17-24, 26, 28; +375 44 742-55-60
Е-mail: adverse@drreddys.com
Республика Казахстан
Представительство компании «Д-р Редди’с Лабораторис Лимитед» в Республике Казахстан
050057, г. Алматы, ул. 22 линия, 45
Тел.: 8 (7273) 94-13-05; 394-12-94; +7 (7017) 63-38-05
E-mail: Maira.Zhagiparova@drreddys.com
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации:
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
Общая характеристика лекарственного препарата Диспевикт доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» http://еес.eaeunion.org/
Комментарии (2)