Категории
Сменить пароль!
Сброс пароля!


Международная федерация диабета в 2021 году дала оценку числа пациентов с углеводными нарушениями во всем мире: 537 миллионов взрослых с сахарным диабетом и около 541 миллиона — с высоким риском развития СД 2-го типа (СД2). Притом ежегодно несколько миллионов пациентов умирают в связи с микро- и макрососудистыми осложнениями, развившимися в ходе естественного течения СД2.
Поэтому для предупреждения и снижения частоты возможных сердечно-сосудистых заболеваний (ССЗ) основной целью терапии СД2 является контроль факторов сердечно-сосудистого (СС) риска, среди которых, помимо классических кардиологических факторов, значится и гипергликемия [1].
1. Поэтапная интенсификация терапии в рекомендациях прошлых лет

Стартовая монотерапия


По этим причинам стандартом стартовой терапии стал метформин, который воздействует на процессы глюконеогенеза и инсулинорезистентность, считавшиеся ранее ключевыми в патогенезе и прогрессировании СД2 [3].

Последующие исследования подтвердили, что скорость ускользания терапевтического эффекта определяется тем, как действует и на какие патогенетические механизмы заболевания направлена выбранная терапия [4].
По современным представлениям определяющую роль в патогенезе СД2 отводят не только нарушенной чувствительности к инсулину (инсулинорезистентности), но и неуклонно снижающейся секреции инсулина (потере функции β-клетки) [5].
По данным ранее упомянутого исследования UKPDS, было показано, что около половины секреторной способности β-клеток утрачено к моменту установления диагноза СД2 [2].
В кросс-секционном анализе 2023 г. на данных пациентов, включавшихся в исследования по вилдаглиптину, было в очередной раз подтверждено, что у пациентов с СД2, не находящихся на терапии, в целом по популяции анализа функция β-клетки уже на старте заболевания в среднем снижена на треть. И снижение было тем больше выражено, чем более выраженным отмечалось нарушение углеводного обмена в момент постановки диагноза СД2. Наиболее сохранная функция β-клетки наблюдалась у пациентов с HbA1c <7% (Рис.1) [6].
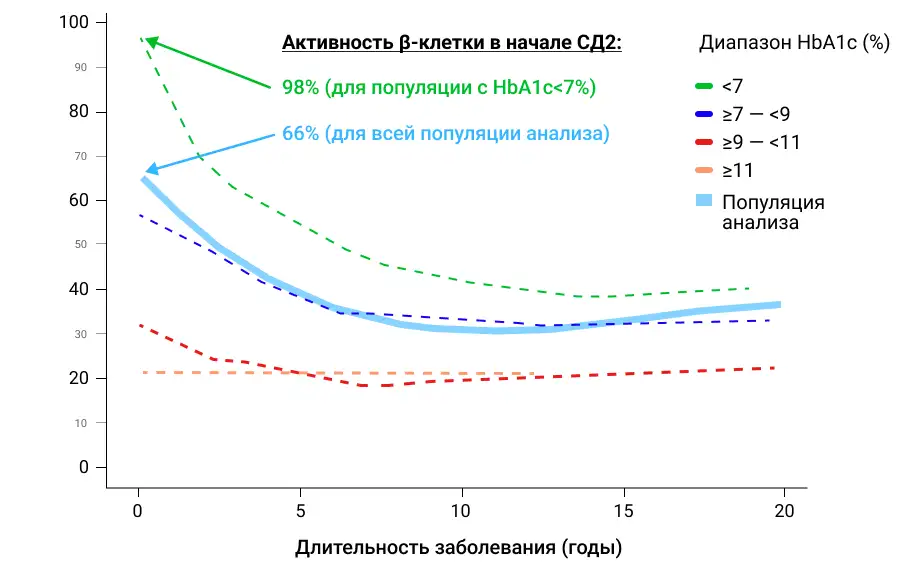
Рисунок 1. Кросс-секционный анализ оценки функции β-клетки (HOMA-B) в зависимости от длительности СД2 у пациентов, не находящихся на терапии ССП: в целом по популяции анализа и стратифицированных по уровню исходного HbA1c.
В анализе было также продемонстрировано, что снижение функции β-клетки имело гиперболическую зависимость от длительности заболевания и наибольшая скорость потери функции наблюдалась в первые 3,8 лет [6].
На основании этих данных авторы анализа обращают особое внимание на важность интервенций, улучшающих функцию β-клетки, особенно у пациентов на более ранних этапах заболевания и с меньшими нарушениями углеводного обмена [6].

Последующая комбинированная терапия
Несмотря на расширение представлений о патогенезе прогрессирующей природы углеводных нарушений, метформин долгое время оставался предпочтительной опцией старта терапии у пациентов с СД2, а в управлении избыточной гликемией был широко принят подход поэтапной интенсификации терапии (ПИТ). Этот подход предполагал, что после старта терапии метформином для назначения дополнительного ССП необходимо было дожидаться потери или недостижения контроля уровня HbA1c.


В отношении интенсификации терапии большинство мировых рекомендаций ранее советовали через каждые 3-6 месяцев оценивать степень достижения и удержания целей HbA1c после старта монотерапии и интенсифицировать терапию лишь в случае нахождения значений за целевым уровнем [3].

На практике же пациенты после стартовой терапии только метформином терялись для наблюдения, врачи опасались интенсифицировать терапию из-за усложнения режима, снижения приверженности терапии, безопасности и других аспектов.
Поэтому подход ПИТ приводил к явлению клинической инерции — задержке назначения следующей линии терапии — и, как следствие, к длительному нахождению пациентов в состоянии избыточной гипергликемии, которого можно было бы потенциально избежать [7].


На положительном контрасте долгое время выступали Российские рекомендации. В соответствии с предложенным ими алгоритмом терапии, пациентам, чей исходный HbA1c превышал целевой на 1,0%, рекомендовалось со старта заболевания назначать исходную комбинацию препаратов для достижения целевых показателей [8].
Однако пациентам, имеющим на старте терапии относительно невысокий уровень HbA1c (6,5-7,5%), все так же рекомендовалось использовать ПИТ [8].

В недавно опубликованном анализе реальной практики The Diabetes & Aging Study исследователи оценили влияние своевременности гликемического контроля на долгосрочные исходы пациентов [9].
На выборке из 35000 пациентов с недавно установленным диагнозом СД2 было показано, что, при всех прочих равных, чем дольше была задержка интенсификации терапии, тем хуже был ожидаемый СС прогноз пациентов [9].
Притом у пациентов, уровень HbA1c которых даже 1 год превышал 6,5%, было отмечено значимое увеличение долгосрочного риска развития СС событий [9].
Источники:
1. Magliano DJ, Boyko EJ, IDF Diabetes Atlas 10th edition scientific committee. IDF DIABETES ATLAS. 2021 [cited 29 Aug 2023]. Available: https://www.ncbi.nlm.nih.gov/books/NBK581934/
2. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998;352: 854–865. Available: https://www.ncbi.nlm.nih.gov/pubmed/9742977
3. American Diabetes Association. Abridged for Primary Care Providers. Clin Diabetes. 2017;35: 5–26. doi:10.2337/cd16-0067
4. Viberti G, Kahn SE, Greene DA, Herman WH, Zinman B, Holman RR, Haffner SM, Levy D, Lachin JM, Berry RA, Heise MA, Jones NP, Freed MI. A diabetes outcome progression trial (ADOPT): an international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes. Diabetes Care. 2002 Oct;25(10):1737-43. doi: 10.2337/diacare.25.10.1737.
5. Kahn SE. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 2003 Jan;46(1):3-19. doi: 10.1007/s00125-002-1009-0
6. Blüher, M, Malhotra, A, Bader, G. Beta-cell function in treatment-naïve patients with type 2 diabetes mellitus: Analyses of baseline data from 15 clinical trials. Diabetes Obes Metab. 2023; 25(5): 1403-1407. doi:10.1111/dom.14969
7. Khunti K, Wolden ML, Thorsted BL, Andersen M, Davies MJ. Clinical inertia in people with type 2 diabetes: a retrospective cohort study of more than 80,000 people. Diabetes Care. 2013 Nov;36(11):3411-7. doi: 10.2337/dc13-0331.
8. Dedov I.I., Shestakova M.V., Mayorov A.Y., Vikulova O.K., Galstyan G.R., Kuraeva T.L., Peterkova V.A., Smirnova O.M., Starostina E.G., Surkova E.V., Sukhareva O.Y., Tokmakova A.Y., Shamkhalova M.S., Jarek-Martynova I.R., Beshlieva D.D., Bondarenko O.N., Volevodz N.N., Grigoryan O.R., Esayan R.M., Ibragimova L.I., Kalashnikov V.Y., Lipatov D.V., Shestakova E.A. Standards of specialized diabetes care. Edited by Dedov II, Shestakova MV, Mayorov AY. 8th edition. Diabetes mellitus. 2017;20(1S):1-121. (In Russ.). https://doi.org/10.14341/DM20171S8
9. Laiteerapong N, Ham SA, Gao Y, Moffet HH, Liu JY, Huang ES, et al. The Legacy Effect in Type 2 Diabetes: Impact of Early Glycemic Control on Future Complications (The Diabetes & Aging Study). Diabetes Care. 2019;42: 416–426. doi:10.2337/dc17-1144
10. Davies MJ, D’Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone G, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018;41: 2669–2701. doi:10.2337/dci18-0033
11. Cosentino F, Grant PJ, Aboyans V, Bailey CJ, Ceriello A, Delgado V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020;41: 255–323. doi:10.1093/eurheartj/ehz486
12. Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140: e596–e646. doi:10.1161/CIR.0000000000000678
13. Buse JB, Wexler DJ, Tsapas A, Rossing P, Mingrone G, Mathieu C, et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020;43: 487–493. doi:10.2337/dci19-0066
14. American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Diabetes Care. 2020;43: S98–S110. doi:10.2337/dc20-S009
15. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Diabetes Care. 2021;44: S15–S33. doi:10.2337/dc21-S002
16. American Diabetes Association Professional Practice Committee. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022;45: S17–S38. doi:10.2337/dc22-S002
17. ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, Bruemmer D, et al. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46: S140–S157. doi:10.2337/dc23-S009
18. Bethel MA, Sourij H. Impact of FDA guidance for developing diabetes drugs on trial design: from policy to practice. Curr Cardiol Rep. 2012;14: 59–69. doi:10.1007/s11886-011-0229-7
19. Matthews DR, Paldánius PM, Proot P, Chiang Y, Stumvoll M, Del Prato S, et al. Glycaemic durability of an early combination therapy with vildagliptin and metformin versus sequential metformin monotherapy in newly diagnosed type 2 diabetes (VERIFY): a 5-year, multicentre, randomised, double-blind trial. Lancet. 2019;394: 1519–1529. doi:10.1016/S0140-6736(19)32131-2
20. Шестакова М.В., Анциферов М.Б., Аметов А.С., Галстян Г.Р., Демидова Т.Ю., Зилов А.В., Маркова Т.Н., Петунина Н.А., Черникова Н.А., Шамхалова М.Ш. Какие новые возможности для клинической практики открывает исследование VERIFY и какова его ценность для пациентов с впервые выявленным СД 2 типа? Совместное заключение по итогам экспертного совета. 6 ноября 2019 г. Сахарный диабет. 2020;23(1):106-110. https://doi.org/10.14341/DM12404
21. Клинические рекомендации. Сахарный диабет 2 типа у взрослых. 2022 г. https://cr.minzdrav.gov.ru/recomend/290_2 (доступ: сентябрь 2023 г.)
22. Aroda VR, Henry RR, Han J, Huang W, DeYoung MB, Darsow T, et al. Efficacy of GLP-1 receptor agonists and DPP-4 inhibitors: meta-analysis and systematic review. Clin Ther. 2012;34: 1247–1258.e22. doi:10.1016/j.clinthera.2012.04.013
23. Esposito K, Chiodini P, Maiorino MI, Capuano A, Cozzolino D, Petrizzo M, et al. A nomogram to estimate the HbA1c response to different DPP-4 inhibitors in type 2 diabetes: a systematic review and meta-analysis of 98 trials with 24 163 patients. BMJ Open. 2015;5: e005892. doi:10.1136/bmjopen-2014-005892
24. Ahrén B, Mathieu C, Bader G, Schweizer A, Foley JE. Efficacy of vildagliptin versus sulfonylureas as add-on therapy to metformin: comparison of results from randomised controlled and observational studies. Diabetologia. 2014;57: 1304–1307. doi:10.1007/s00125-014-3222-z
25. Brath H, Paldánius PM, Bader G, Mathieu C. Relationship Between Duration of Type 2 Diabetes and Effectiveness of DPP-4 Inhibitor Versus Sulfonylurea as Add-on Therapy: A Post Hoc Analysis. Diabetes Ther. 2017;8: 829–836. doi:10.1007/s13300-017-0276-1
26. Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2015;373: 232–242. doi:10.1056/NEJMoa1501352
27. Schernthaner G, Cahn A, Raz I. Is the Use of DPP-4 Inhibitors Associated With an Increased Risk for Heart Failure? Lessons From EXAMINE, SAVOR-TIMI 53, and TECOS. Diabetes Care. 2016;39 Suppl 2: S210–8. doi:10.2337/dcS15-3009
28. Crowley MJ, Williams JW Jr, Kosinski AS, D’Alessio DA, Buse JB. Metformin Use May Moderate the Effect of DPP-4 Inhibitors on Cardiovascular Outcomes. Diabetes Care. 2017;40: 1787–1789. doi:10.2337/dc17-1528
29. Schweizer A, Dejager S, Foley JE, Couturier A, Ligueros-Saylan M, Kothny W. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab. 2010;12: 485–494. doi:10.1111/j.1463-1326.2010.01215.x
30. McInnes G, Evans M, Del Prato S, Stumvoll M, Schweizer A, Lukashevich V, et al. Cardiovascular and heart failure safety profile of vildagliptin: a meta-analysis of 17 000 patients. Diabetes Obes Metab. 2015;17: 1085–1092. doi:10.1111/dom.12548
31. Evans M, Kozlovski P, Paldánius PM, Foley JE, Bhosekar V, Serban C, et al. Factors that may Account for Cardiovascular Risk Reduction with a Dipeptidyl Peptidase-4 Inhibitor, Vildagliptin, in Young Patients with Type 2 Diabetes Mellitus. Diabetes Ther. 2018;9: 27–36. doi:10.1007/s13300-017-0329-5
32. Paldánius PM, Del Prato S, Stumvoll M, Matthews DR. Effect on beta cell function in newly diagnosed type 2 diabetes patients after treatment with vildagliptin and metformin: results from the VERIFY study. ePoster # 609_PDF. EASD Virtual meeting, 2020.
33. Matthews DR, Paldánius PM, Bader G, Del Prato S. Beta cell activity modulates treatment response in treatment-naive patients: exploratory analysis from the VERIFY study. Abstract # 336. EASD Virtual meeting, 2021.
Комментарии (0)