Категории
Сменить пароль!
Сброс пароля!


Согласно классификации, принятой Европейской академией аллергологии и клинической иммунологии (EAACI, 2003), выделяют два поколения блокаторов Н1-гистаминовых рецепторов: первое поколение, или седативные антигистаминные препараты (АГП), и второе поколение - неседативные АГП (нс Н1-АГП) [1]. К препаратам первого поколения относятся хлоропирамин, клемастин, дифенгидрамин, ципрогептадин, мебгидролин, хифенадин, диметинден и др. Большинство из них были синтезированы в середине прошлого века, но с успехом применяются и в настоящее время
Согласно классификации, принятой Европейской академией аллергологии и клинической иммунологии (EAACI, 2003), выделяют два поколения блокаторов Н1-гистаминовых рецепторов: первое поколение, или седативные антигистаминные препараты (АГП), и второе поколение - неседативные АГП (нс Н1-АГП) [1]. К препаратам первого поколения относятся хлоропирамин, клемастин, дифенгидрамин, ципрогептадин, мебгидролин, хифенадин, диметинден и др. Большинство из них были синтезированы в середине прошлого века, но с успехом применяются и в настоящее время
У многих пациентов с хронической крапивницей сложно купировать зуд. Можно ли применять в таких случаях антигистаминные препараты (АГП) 2-го поколения в дозах, превышающих стандартные?

30 июня 2022 года в Москве проводился Cовет экспертов на тему: «Применение цетиризина и левоцетиризина у пациентов с крапивницей и другими аллергодерматозами: вопросы повышения дозировки и длительного применения». В заседании приняли участие эксперты в области дерматовенерологии, аллергологии - иммунологии. Совет стал площадкой для обсуждения накопившихся клинических и организационных проблем в области ведения пациентов с хронической крапивницей и другими аллергодерматозами. В рамках Совета также обсуждались возможности длительного применения цетиризина, левоцетиризина и использования высоких доз этих препаратов в клинической практике. Предметом дискуссии стал вопрос алгоритма эскалации и последующей деэскалации дозы антигистаминных препаратов.
Антигистаминные препараты: общие вопросы
Согласно классификации, принятой Европейской академией аллергологии и клинической иммунологии (EAACI, 2003), выделяют два поколения блокаторов Н1-гистаминовых рецепторов: первое поколение, или седативные антигистаминные препараты (АГП), и второе поколение - неседативные АГП (нс Н1-АГП) [1]. К препаратам первого поколения относятся хлоропирамин, клемастин, дифенгидрамин, ципрогептадин, мебгидролин, хифенадин, диметинден и др. Большинство из них были синтезированы в середине прошлого века, но с успехом применяются и в настоящее время. К особенностям этой группы препаратов можно отнести быстрое начало эффекта, наличие инъекционных форм, но в то же время короткую продолжительность терапевтического действия (1,5–6 часов) и ряд побочных эффектов, ограничивающих их длительное применение в клинической практике. Большинство антигистаминных препаратов первого поколения являются конкурентными блокаторами Н1-рецепторов; они характеризуются высокой липофильностью, обеспечивающей проникновение через гематоэнцефалический барьер (ГЭБ), выраженным воздействием на центральную нервную систему, развитием побочных эффектов, таких как сонливость, сухость слизистых, нарушение когнитивных функций, усиливающихся при совместном применении с алкоголем или седативными средствами. Неполное связывание с Н1-рецепторами (30%) обусловливает необходимость использования высоких терапевтических доз и частую кратность приёма этих препаратов, а также быстрое развитие тахифилаксии к ним [2]. Седативные антигистаминные препараты (за исключением доксиламина) угнетают быструю фазу сна (rapid eye movement, REM), после чего вызывают выраженный синдром отмены [3]. Ещё одной особенностью АГП первого поколения является низкая избирательность действия: помимо Н1 - гистаминовых рецепторов, они блокируют и рецепторы других типов: М-холинорецепторы, α-адренорецепторы, серотониновые, брадикининовые рецепторы. Именно поэтому большинство седативных АГП имеют ряд серьёзных ограничений к применению у пациентов с глаукомой, бронхиальной астмой, доброкачественной гиперплазией предстательной железы, сердечно сосудистой патологией, патологией ЖКТ и т. д. [3].
Ограничение использования АГП первого поколения для длительного контроля симптомов аллергических заболеваний из-за развития тахифилаксии и различных побочных эффектов способствовало созданию новых блокаторов гистаминовых Н1-рецепторов второго поколения, для которых характерны высокое сродство к Н1-рецепторам и высокая специфичность. По рекомендации европейских экспертов антигистаминные препараты первого поколения были ограничены к использованию у детей до 6 лет и изъяты из безрецептурной продажи в странах Евросоюза и США [4-7]. Нc Н1-АГП являются разнородной группой, прежде всего в силу особенностей их метаболизма. Среди АГП второго поколения выделяют две подгруппы:
Индивидуальной вариабельностью активности системы цитохрома Р450 может быть объяснена различная эффективность «метаболизируемых» препаратов у разных лиц. При недостаточном метаболизме также возрастает риск побочных токсических эффектов со стороны сердечно-сосудистой системы (удлинение интервала QT и нарушение желудочкового ритма), что было отмечено у терфенадина и астемизола. «Активные метаболиты» обладают более высоким профилем безопасности, при этом эффект этих препаратов более предсказуем и не зависит от активности ферментов системы цитохрома Р450, поэтому их применение является предпочтительным [3].
Крайне важным в лечении крапивницы и других аллергодерматозов являются высокое сродство АГП второго поколения к Н1-рецепторам, быстрое начало действия, высокая избирательность действия, возможность однократного приема в сутки. Эти препараты не проникают через ГЭБ, поэтому практически не вызывают сонливости. Нс Н1-АГП не только взаимодействуют с H1-гистаминовыми рецепторами по принципу обратных агонистов, но и подавляют высвобождение провоспалительных медиаторов, уменьшают экспрессию молекул адгезии [Inter-Cellular Adhesion Molecule 1 (ICAM-1)], подавляют индуцированное эозинофилами выделение интерлейкина 8 (ИЛ-8), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) из эпителиальных клеток, поэтому они более эффективны, чем АГП первого поколения [8].
Согласно международным и российским согласительным документам в качестве препаратов первой линии выбора при лечении крапивницы назначаются нс Н1-АГП. Необходимость применения блокаторов Н1-гистаминовых рецепторов в лечении аллергодерматозов имеет высокую доказательную базу и обусловлена механизмом их действия, позволяющим подавить гистамин-опосредованные эффекты аллергического воспаления, зуд и улучшить качество жизни пациента [9-11]. Особая роль АГП второго поколения в лечении зудящих аллергодерматозов определяется их противозудным, противовоспалительным, противоаллергическим эффектами [12-14].
Левоцетиризин и цетиризин: эффективность и безопасность
Тенденции современной медицинской науки требуют определения клинического или клинико-лабораторного фенотипа заболевания у каждого конкретного пациента, что и является основой для выбора персонализированной терапии. Персонализированным также является и выбор препарата для купирования зуда и воспаления у пациентов с аллергодерматозами. Анализ возможностей купирования гистамин-опосредованных проявлений аллергодерматозов показал наибольший потенциал эффективности цетиризина и левоцетиризина среди АГП второго поколения [15-18]. Результаты клинического изучения и реальная практика свидетельствуют о том, что “золотым” стандартом среди нс Н1-АГП заслуженно считается цетиризин - первый высокоизбирательный блокатор Н1-рецепторов [3,17-21]. С использованием цетиризина проведено больше клинических исследований, чем с другими антигистаминными препаратами. Показано, что для пациентов, которые плохо отвечают на терапевтическое действие других блокаторов Н1-гистаминовых рецепторов, предпочтителен именно цетиризин [3,18].
Цетиризин обладает высокоизбирательным сродством к периферическим Н1-рецепторам гистамина. Сродство цетиризина к Н1-рецепторам выше, чем у лоратадина и такое же как у астемизола, терфенадина и гидроксизина [3]. При этом специфичность связывания Н1-рецепторов оказывается очень высокой: даже в высоких концентрациях цетиризин не блокирует серотониновые (5-НТ2), допаминовые (D2), М-холинорецепторы и α1-адренорецепторы [18]. Действие цетиризина распространяется не только на раннюю, но и на позднюю фазу аллергической реакции. Цетиризин тормозит in vitro активацию эозинофилов, вызванную интерлейкином 8, лейкотриеном В4 и С5а компонентом комплемента, хемотаксис этих клеток, вызванный фактором активации тромбоцитов (ФАТ) или хемотаксическим агентом – формил-метионил-лейцил-фенилаланином. В таких же концентрациях цетиризин тормозит стимулированную специфическим аллергеном цитотоксичность тромбоцитов [3]. Для цетиризина характерны низкий объем распределения (0,56 л/кг массы тела) по сравнению с другими антагонистами Н1-рецепторов и высокая способность проникновения в кожу. Преимущества низкого объема распределения включают в себя минимально зависимую от дозы клеточную и органную токсичность, минимальную индивидуальную вариабельность терапевтического эффекта, низкую вероятность нежелательных взаимодействий препарата с другими лекарственными средствами и отсутствие аккумуляции его в таких жизненно важных органах, таких как как сердце и печень, а поэтому потенциально хорошую переносимость и высокую безопасность. В терапевтических дозах цетиризин тормозит выход гистамина в межклеточное пространство, вызванный длительным контактом специфического аллергена с кожей чувствительного к нему пациента [3, 22]. В последнее время получены сведения, иллюстрирующие выраженное тормозящее действие цетиризина на персистирующее воспаление в тканях и перестройку профиля продуцируемых цитокинов [12]. Кроме того, в отличие от других препаратов, применяемых при кожных проявлениях аллергии, цетиризин не только блокирует H1-гистаминовые рецепторы, но и подавляет кожный ответ на тромбоцит-активирующий фактор [22,23]. Это подтверждено результатами сравнительных исследований: способность кумулироваться в коже позволяет препарату тормозить волдырную и гиперемическую реакцию более эффективно, чем эбастину, биластину, фексофенадину, лоратадину и дезлоратадину [24-26].
Левоцетиризин не только является мощным антигистаминным средством, но также обладает противоаллергическими/ противовоспалительными свойствами, часть из которых не связаны с блокадой H1-рецепторов. Он эффективно подавляет кожную аллергическую реакцию, и его ингибиторная активность коррелирует с высокой занятостью рецепторов [16, 27]. В исследованиях по изучению эффективности подавления гистамин-индуцированной реакции левоцетиризин показал лучшие результаты по сравнению с эбастином, фексофенадином, лоратадином и мизоластином [28]. В связи с низким объемом распределения (0,4 л/кг), левоцетиризин обнаруживается в тканях только там, где это необходимо, а именно на клеточной мембране, и не проникает внутрь клетки. Ряд исследований показывает, что относительно высокие концентрации левоцетиризина на клеточной поверхности в рецепторных участках обуславливают выраженность эффекта и длительную активность препарата. Левоцетиризин создает высокие концентрации в коже [16]. Левоцетиризин практически не проникает через ГЭБ, и его седативный потенциал еще меньше, чем у цетиризина, лоратадина и дезлоратадина. Клинически значимые взаимодействия с пищей и лекарственными препаратами отсутствуют [29, 30].
По результатам сравнительных исследований, левоцетиризин в дозе 5 мг значимо эффективнее и быстрее, чем дезлоратадин в дозе 5 мг, действует на симптомы хронической спонтанной крапивницы (ХСК). Левоцетиризин сильнее подавляет воспаление, чем дезлоратадин, т.к. он значительнее снижает уровень таких провоспалительных цитокинов, как ИЛ-1β и ИЛ-8. Установленное клиническое преимущество левоцетиризина над дезлоратадином при применении в дозе 5 мг один раз в сутки утром может являться обоснованием применения левоцетиризина в дозе 5 мг в качестве предпочтительного варианта лечения взрослых пациентов с хронической спонтанной крапивницей [27,31]. Препарат быстро всасывается из ЖКТ, не взаимодействует с системой цитохрома Р 450, начинает действовать через 12 минут, достигая максимальной концентрации в плазме уже через 54 минуты [32, 34].
Таким образом, данные об эффективности и безопасности АГП второго поколения из группы «активных метаболитов» делают их наиболее приемлемыми для длительного использования в клинической практике, а цетиризин и левоцетиризин соответствуют требованиям применения нс Н1-АГП для длительного контроля аллергических заболеваний или крапивницы, в ситуациях, когда это необходимо [27].
Использование дженериков Н1-антигистаминных препаратов в лечении крапивницы и других аллергодерматозов является очень важным сегментом оптимальной высокоэффективной длительной финансовосберегающей терапевтической схемы с минимальной фармаконагрузкой, сохраняющей качество жизни «трудного» пациента. Поэтому чрезвычайно важным является владение врачом принципами рациональной фармакотерапии, позволяющими сделать оптимальный выбор Н1-антигистаминного препарата с учетом всех его возможных характеристик.
Одним из высокоэффективных воспроизведенных цетиризинов является Цетрин®. Препарат действует быстро, продолжительно, обладает хорошим профилем безопасности. Цетрин® практически не метаболизируется в организме. Максимальная концентрация в сыворотке достигается через час после приема, при продолжительном применении не накапливается в организме. Начало эффекта после разового приема 10 мг препарата – через 20 мин. Цетрин® полностью биоэквивалентен референтному препарату. Эффективно используется при крапивнице, в том числе хронической спонтанной. Следует подчеркнуть, что из числа разных представителей цетиризина, зарегистрированных в нашей стране, Цетрин® (компания Dr. Reddy’s Laboratories LTD) отличает большая доказательная база и длительный опыт широкого медицинского применения [3, 34]. Наличие в показаниях к применению препарата крапивницы, других зудящих аллергических дерматозов, таких как атопический дерматит, является большим преимуществом Цетрин®, которое является основанием для врачей действовать в рамках нормативных документов, рекомендуя его [36].
Антигистаминный препарат Аллервэй (левоцетиризин) имеет также доказанную биоэквивалентность и терапевтическую эквивалентность референтному препарату [37, 38]. Помимо этого, Аллервэй имеет оригинальную форму выпуска Аллервэй Экспресс, диспергируемые таблетки, аналогов которой среди левоцетиризинов в России нет. Данная лекарственная форма помогает пройти курс терапии при сопутствующих симптомах дисфагии, детям старше 6 лет, а также хорошо подходит для использования в путешествиях, в дороге. Препараты Аллервэй/Аллервэй Экспресс зарегистрированы для лечения аллергического ринита, крапивницы, аллергического конъюнктивита, поллиноза, аллергических дерматозов, сопровождающихся зудом и высыпаниями; их применение возможно у беременных и кормящих женщин [32, 33, 37].
Подводя итоги, можно сказать, что оба препарата демонстрируют соответствие всем принципам рациональной фармакотерапии: наряду с эффективностью в отношении купирования гистамин-опосредованных эффектов (купирование зуда и воспаления), они демонстрируют высокую безопасность и комплаенс, что подтверждается клинической практикой.
Вопросы длительного применения Н1-АГП
Имеются данные об эффективности и безопасности длительного применения цетиризина и левоцетиризина у пациентов с различными аллергическими заболеваниями. Безопасность и эффективность левоцетиризина в дозе 5 мг/сутки была продемонстрирована в ряде исследований на протяжении 18 месяцев, а том числе в педиатрической практике у детей раннего возраста [27, 39, 40].
Эффективность длительного применения цетиризина также была подтверждена в ряде исследований и были сделаны выводы, что с учетом доказанной безопасности цетиризина, длительное (до 18 месяцев) использование этого препарата может помочь сократить продолжительность применения и количество топических кортикостероидов, используемых при лечении детей с атопическим дерматитом. В ходе исследований не было отмечено развитие тахифилаксии к цетиризину, его эффективность сохранялась на протяжении всего периода наблюдения [41, 42].
Данные об эффективности и безопасности применения высоких доз цетиризина и левоцетиризина
Сложность купирования гистамин-опосредованного зуда при различных формах крапивницы в существенном проценте случаев требует применения высоких дозировок нс Н1-АГП. Обоснование и разрешение применения 4-кратного увеличения стандартной дозы АГП второго поколения было отражено в рекомендательных письмах EAACI/WAO, начиная с 2006 года [43]. Данная практика применения цетиризина и левоцетиризина широко изучена в двойных слепых плацебо-контролируемых исследованиях. Так, в ходе тройного слепого сравнительного рандомизированного исследования при повышении суточной дозы антигистаминных препаратов в 2 и 4 раза цетиризин показал хорошую эффективность и несколько более быстрое снижение дерматологического индекса качества жизни [The Dermatology Life Quality Index (DLQI)] по сравнению с фексофенадином, эбастином, биластином и дезлоратадином. Кроме того, для купирования симптомов при тяжелом течении хронической крапивницы только у 10,7% пациентов в группе цетиризина суточная доза была постепенно увеличена до 4 таблеток в сутки по сравнению с необходимостью увеличения дозы до четырехкратной в группе фексофенадина - у 40% (р=0,03) [26]. В ходе проспективного рандомизированного открытого сравнительного исследования эффективности применения цетиризина у пациентов с хронической крапивницей было выявлено, что купирование симптомов и улучшение качества жизни у пациентов с первично недостаточным ответом на лечение было эффективнее в группе, получившей увеличенную суточную дозу цетиризина до 20 мг на втором этапе, чем в группе, в которой происходила замена нс Н1-АГП [44].
Результаты двойного слепого плацебо-контролируемого исследования показали, что трехнедельное применение цетиризина в дозе 20 мг / сутки у пациентов с холинергической крапивницей привело к статистически значимому уменьшению волдырей (р = 0,015), эритемы (р = 0,033), зуда (р = 0,006) и других симптомов (р = 0,013). При этом не было отмечено повышение количества нежелательных явлений по сравнению с группой, получавшей плацебо [45].
В клинической практике цетиризин доказал свою эффективность при лечении различных форм крапивницы и для уменьшения зуда при атопическом дерматите. Для этих состояний часто рекомендуются дозы выше 10 мг (до 40 мг) для достижения наилучшего эффекта. При этом подбирать индивидуальную дозировку следует исходя из степени выраженности симптомов [10, 17, 35]. Цетиризин рекомендован в составе комплексной терапии при мастоцитозе, особенно у детей [46]. Может быть использован в схемах терапии пруриго, в том числе в кратных дозах [47, 48].
Клинический опыт свидетельствует о полном контроле уртикарных высыпаний у 75% пациентов с крапивницей на фоне 4-кратного увеличения дозы левоцетиризина с восстановлением параметров качества жизни и с сохранением полного спектра параметров безопасности [49].
Также, по мнению исследователей, высокоэффективной является тактика постепенного увеличения дозовой нагрузки нс Н1-АГП у пациентов с резистентными формами ХСК. Так, в открытом проспективном клиническом исследовании на 113 пациентах было показано, что последовательное повышение дозы левоцетиризина привело к прогрессивному улучшению как контроля крапивницы (UAS-7), так и качества жизни (CU-Q2oL) без значительного увеличения сонливости [50].
Безопасность высокой дозовой нагрузки левоцетиризина продемонстрирована в исследовании индийских коллег. Так, 4-кратное увеличение дозы у пациентов с хронической крапивницей непрерывно рецидивирующего течения в течение 4 недель сопровождалось незначительным седативным эффектом (по градации 0-отсутсвует, 1-незначительтная, 2- умеренная, 3- значительная), а двукратное увеличение дозы не вызывало сонливости [51].
Доказательная база по эффективности высоких доз левоцетиризина при ХСК также включает в себя результаты исследований по оценке уровня инозитола трифосфата (посредника, принимающего участие в передаче сигнала в клетке и образующегося в результате распада мембранных фосфолипидов под действием фермента фосфолипазы С) при трехкратном увеличении терапевтической дозы левоцетиризина, коррелирующего с контролем уртикарных высыпаний [52].
В связи с тем, что ранее были зафиксированы нежелательные явления со стороны сердечно-сосудистой системы при использовании некоторых АГП второго поколения - терфенадина и астемизола, важно выбирать препарат с учетом рисков нежелательных явлений, в особенности у пациентов, имеющих в анамнезе эпизоды нарушения ритма или изменения на ЭКГ. Безопасность высоких доз левоцетиризина в этом аспекте подтверждена рядом исследований. Так, в изучении влияния на интервалы QT здоровых добровольцев 6-кратных доз левоцетиризина в двойном слепом плацебо-контролируемом исследовании, было показано, что однократный прием высокой дозы левоцетиризина в течение последующих 24 часов не вызывает никаких нарушений в деятельности сердечно-сосудистой системы [53].
В последнее время все большую актуальность представляют вопросы персонализированного подхода к терапии различных заболеваний, в том числе и аллергодерматозов, а также изучаются возможности прогнозирования эффективности лекарственных препаратов у конкретного больного. Так, проспективное рандомизированное тройное слепое исследование, целью которого было определение прогностической роли результатов кожного prick-теста с гистамином у пациентов с ХСК в течение 24 часов после приема одного из антигистаминных препаратов (цетиризина, фексофенадина, биластина, дезлоратадина или эбастина) в течение 8 недель, причем, после 4 недель доза АГП была увеличена у «неответчиков», показало, что изменение диаметра гистамин-индуцированного волдыря через 24 часа обратно коррелировало с индексом качества жизни DLQI. Причем, оказалось, что индекс качества жизни и диаметр гистамин-индуцированного волдыря оказались наиболее чувствительными критериями эффективности терапии АГП. Таким образом, диаметр гистамин-индуцированного волдыря может быть инструментом прогнозирования терапии АГП, хотя в отношении выявления «неответчиков» этот тест оказался не столь эффективным [26].
Выводы:
Заключение
Оценивая антигистаминные препараты второго поколения цетиризин (Цетрин®), левоцетиризин (Аллервэй), эксперты высказались о научной обоснованности и высоком потенциале эффективности и безопасности применения данных препаратов в качестве стратегии длительного контроля над заболеванием у пациентов с хронической крапивницей и другими аллергодерматозами. Было отмечено, что имеющиеся исследования длительного применения (12–18 месяцев) и высоких доз (до четырехкратного увеличения одобренной дозы) проведены по высоким стандартам и подтверждают эффективность и безопасность препаратов. По результатам обсуждения был предложен алгоритм эскалации и деэскалации доз антигистаминных препаратов второго поколения, в том числе у пациентов с хронической крапивницей (рис.1, 2).
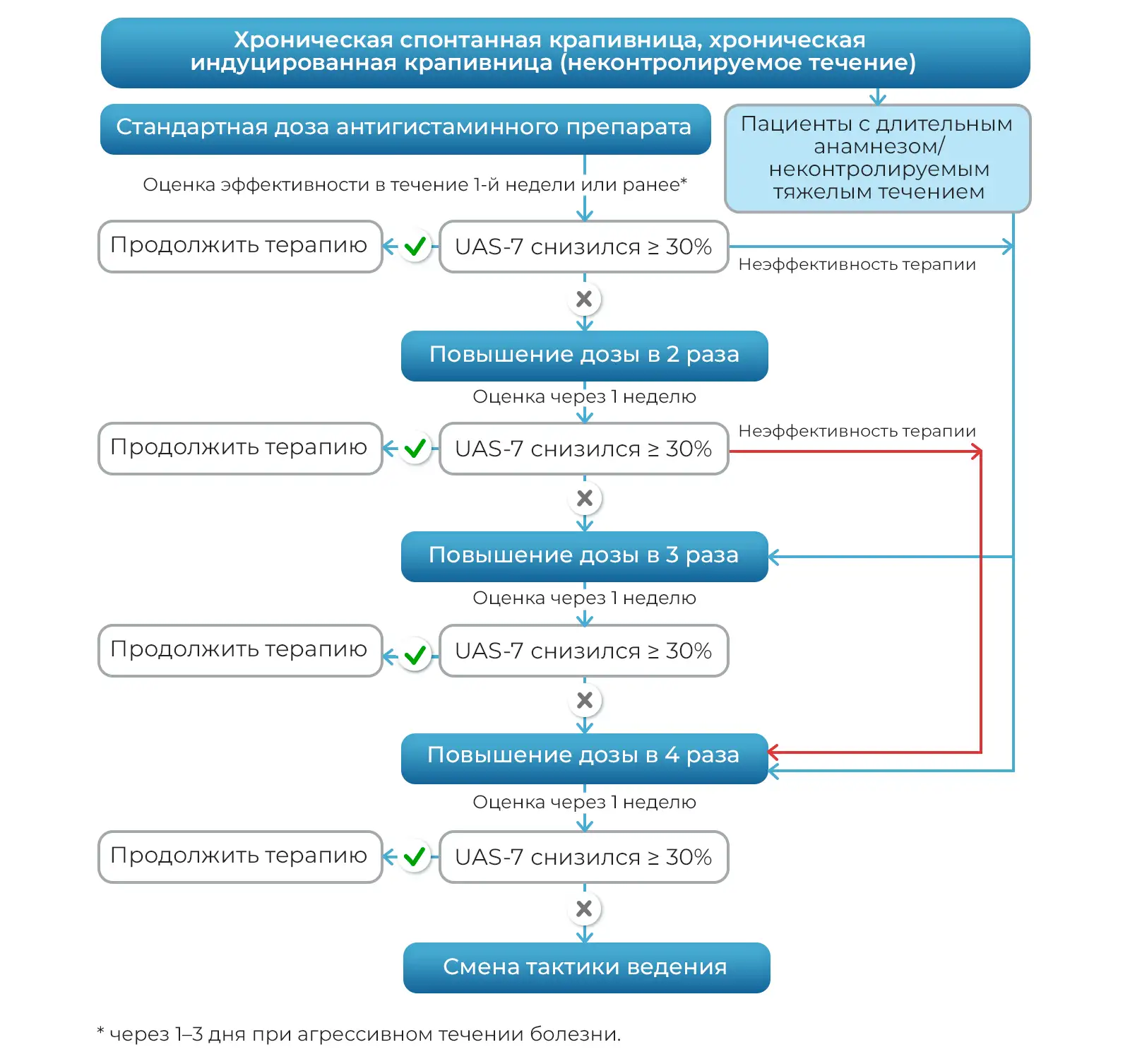
Рисунок 1. Алгоритм эскалации дозы антигистаминного препарата второго поколения
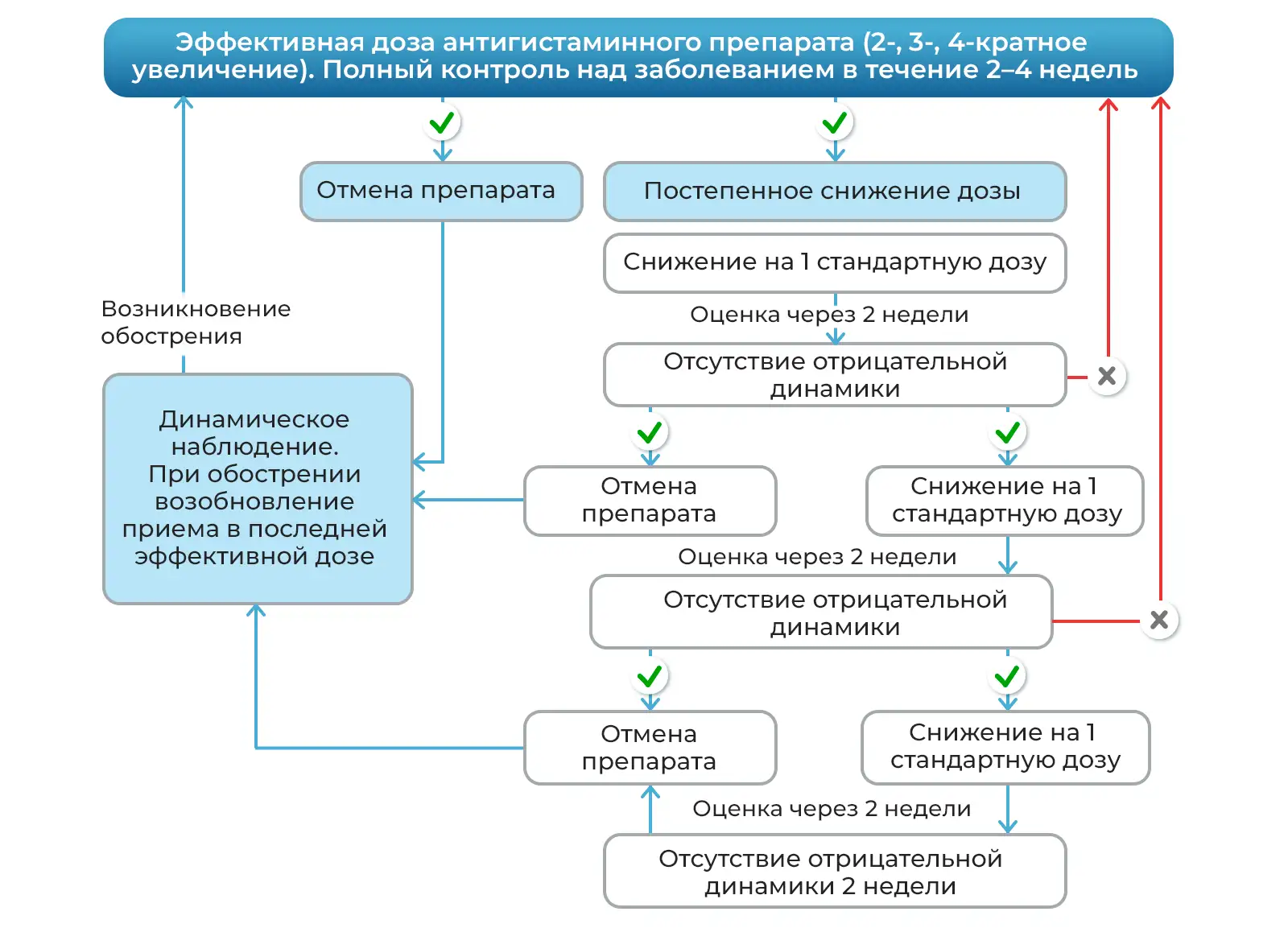
Примечание: Условием выбора пути деэскалации дозы является наличие длительного анамнеза заболевания/неэффективность предыдущего лечения.
Кратная доза нс Н1-АГП делится на два приема в течение дня: утром и вечером.
Рисунок 2. Алгоритм деэскалации дозы антигистаминного препарата второго поколения
СПИСОК УЧАСТНИКОВ
Аравийская Е.Р. д.м.н., профессор кафедры дерматовенерологии с клиникой ПСПбГМУ им акад. И.П. Павлова. Руководитель последипломного цикла обучения по косметологии для врачей. Консультант Санкт-Петербургского Института Красоты "ГАЛАКТИКА". Член Совета Директоров Европейской Академии Дерматологии и Венерологии (EADV). Член Европейских комитетов по лечению Акне, Розацеа и Активной Косметике. Почетный член Общества Франции и Сербии, Санкт-Петербург;
Бакулев А.Л. д.м.н., профессор кафедры дерматовенерологии и косметологии ЦГМА УДП РФ, Москва;
Елисютина О.Г. д.м.н., в.н.с. отделения иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России, Москва;
Гаджигороева А. Г. д.м.н., руководитель отдела клинической дерматовенерологии и косметологии ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии Департамента Здравоохранения г. Москвы», главный врач клиники «Институт Красивых Волос», президент ассоциации «Профессиональное общество трихологов», Москва;
Галимова Е. С. д. м. н., профессор кафедры пропедевтики внутренних болезней ФГБОУ ВО БашГМУ Минздрава России, г. Уфа;
Данилычева И. В. к.м.н., в.н.с. отделения аллергологии и иммунотерапии ФГБУ «ГНЦ Институт иммунологии» ФМБА России, Москва;
Зиганшин О.Р. д.м.н., профессор, заведующий кафедрой дерматовенерологии ФГБОУ ВО ЮУГМУ Минздрава России, главный врач ГБУЗ «ЧОККВД», Главный внештатный специалист по дерматовенерологии и косметологии МЗ Челябинской области, Челябинск;
Ильина Н.И. д.м.н., профессор кафедры клинической аллергологии и иммунологии ФГБОУ ВО МГМСУ им. А. И. Евдокимова, профессор кафедры иммунологии медико-биологического факультета ФГБОУ ВО РНИМУ им. Н.И. Пирогова МЗ РФ, член ученого совета и заместитель председателя диссертационного совета ГНЦ «Институт иммунологии» ФМБА России, первый вице-президент и генеральный директор Российской ассоциации аллергологов и клинических иммунологов (РААКИ), заместитель директора по клинической работе ФГБУ «ГНЦ «Институт иммунологии» ФМБА России, Москва;
Кохан М.М. д.м.н., профессор, заведующий научным клиническим отделом дерматологии, ГБУ СО "Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии", Екатеринбург;
Круглова Л.С. д.м.н., профессор, заведующий кафедрой дерматовенерологии и косметологии, проректор по учебной работе ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента Российской Федерации, Москва;
Львов А.Н. д.м.н., профессор, руководитель отдела аспирантуры и ординатуры, профессор кафедры дерматовенерологии и косметологии ЦГМА УДП РФ; главный научный сотрудник МНОЦ МГУ им. М.В. Ломоносова, Москва;
Матушевская Е.В., д.м.н., профессор кафедры дерматовенерологии и косметологии ФГБОУ ДПО ИПК ФМБА России, Москва;
Мигачева Н. Б. д.м.н., профессор, заведующий кафедрой педиатрии ИПО СамГМУ, врач аллерголог-иммунолог высшей категории СОКБ им. В.Д. Середавина, Самара;
Мурашкин Н.Н. д.м.н., профессор, заведующий отделением дерматологии с группой лазерной хирургии, заведующий лабораторией патологии кожи у детей, руководитель НИИ детской дерматологии ФГАУ «Научный центр здоровья детей» МЗ РФ, Москва;
Немчанинова О.Б. д.м.н., профессор, заведующий кафедрой дерматовенерологии и косметологии НГМУ, Новосибирск;
Ненашева Н.М. д.м.н., профессор, заведующая кафедрой аллергологии и иммунологии ФГБОУ ДПО РМАНПО Минздрава РФ, Москва;
Олисова О.Ю. д.м.н., профессор, член-корреспондент РАН, заведующий кафедрой кожных и венерических болезней имени В.А. Рахманова ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова (Сеченовский Университет)» МЗ РФ, директор клиники кожных и венерических болезней им. В.А. Рахманова, Москва;
Павлинова Е. Б. д.м.н., профессор, заведующий кафедрой госпитальной педиатрии, проректор по учебной работе ФГБОУ ВО ОмГМУ Минздрава России, Омск
Притуло О.А. д.м.н., профессор, заведующий кафедрой дерматовенерологии и косметологии Медицинской академии им. С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского», главный внештатный специалист по дерматовенерологии и косметологии МЗ Крыма, Симферополь;
Репецкая М.Н. д.м.н., профессор, заведующий кафедрой детских болезней лечебного факультета ФГБОУ ВО ПГМУ им. акад. Е.А. Вагнера Минздрава России, Пермь;
Самцов А.В. д.м.н., профессор, заслуженный деятель науки РФ, заведующий кафедрой кожных и венерических болезней ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ, вице-президент РОДВК, Санкт-Петербург;
Сидоренко О.А., д.м.н., профессор, заведующий кафедрой кожных и венерических болезней Ростовского ГМУ, Ростов-на-Дону;
Снарская Е.С. д.м.н., профессор кафедры кожных и венерических болезней имени В.А. Рахманова ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова (Сеченовский Университет)» МЗ РФ, Москва;
Соколовский Е.В. д.м.н., профессор, заведующий кафедрой дерматовенерологии с клиникой ПСПбГМУ им. акад. И.П.Павлова, Санкт-Петербург;
Тамразова О.Б. д.м.н., профессор кафедры дерматовенерологии с курсом косметологии МИ ФНМО РУДН, Москва;
Татаурщикова Н.С. д.м.н., заведующий кафедрой клинической иммунологии, аллергологии и адаптологии ФНМО МИ РУДН, Москва;
Феденко Е.С. д.м.н., профессор, заведующий отделением аллергологии и иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России, заместитель главного редактора «Российского Аллергологического Журнала», Москва.
Федотова Н.В. к.м.н., заведующий Краснодарским краевым аллергологическим центром ГБУЗ «НИИ-ККБ № 1» МЗ Краснодарского края, главный внештатный специалист аллерголог-иммунолог МЗ Краснодарского края, Краснодар;
Шартанова Н.В. д.м.н., заведующий поликлиническим отделением ФГБУ «ГНЦ Институт иммунологии» ФМБА России, Москва;
Юсупова Л.А. д.м.н., профессор, заведующий кафедрой дерматовенерологии и косметологии КГМА – филиала ФГБОУ ДПО РМАНПО Минздрава России, главный внештатный специалист по дерматовенерологии и косметологии МЗ Республики Татарстан, Казань.
КОНФЛИКТ ИНТЕРЕСОВ
Материалы по продуктам были предоставлены компанией ООО Др. Редди’с Лабораторис. Все решения по финальному тексту принимали авторы публикации.

ЛИТЕРАТУРА
Комментарии (0)