Категории
Сменить пароль!
Сброс пароля!



Планирование беременности и сама беременность - важные этапы, которые требуют особого внимания и подготовки. В последние годы все больше внимания уделяется роли холина в этих процессах. Холин, важный нутриент, играет решающую роль в развитии плода, функционировании плаценты и эпигенетических механизмах, влияющих на здоровье будущего поколения. В данной статье мы рассмотрим три основных направления работы холина при планировании беременности и во время самой беременности: эпигенетическое программирование, влияние на функцию плаценты и врожденные пороки развития. Разберем, как холин может влиять на эти процессы и как его достаточное потребление может способствовать здоровому развитию плода и успешному протеканию беременности.

В протеоме человека с холином взаимодействуют более 40 белков, в том числе участвующие в метаболизме, транспорте холина и в функционировании системы холинергических рецепторов. Общеизвестно, что холин и его метаболиты необходимы для биосинтеза фосфолипидов, образующих клеточные мембраны, биосинтеза ацетилхолина и соответственно холинергической нейротрансмиссии, метилирования ДНК (через производное холина бетаин). При участии производных холина (прежде всего, бетаина), фолатов и других витаминов группы В (В2, В6, В12) в клетках синтезируется основной источник метильных групп – молекула S-аденозилметионина [1, 2].
Биосинтез S-аденозилметионина и других молекулдоноров метильной группы для метилирования ДНК и белков играет важную роль в процессах эмбриогенеза и роста плода. Холин, поступающий в материнский организм, влияет на пролиферацию, дифференцировку, морфологию клеток, нейрогенез и потенцирование синапсов гиппокампа плода [1, 3].
Отдельные формы холина обладают еще более широким спектром молекулярно-фармакологического действия. В нейронах ЦДФ-холин дозозависимо влияет на транскрипцию 8838 из 12 716 аннотированных генов человека. Регулируемые холином гены вовлечены в метаболизм нейротрансмиттеров, осуществление эффектов нейротрофических факторов, поддержку сердечно-сосудистой системы. ЦДФ-холин может снижать транскрипцию генов воспаления, повышая экспрессию генов, вовлеченных в метаболизм триглицеридов. В проведенных исследованиях было выявлено, что дефицит холина повышал экспрессию гена провоспалительного толл-рецептора TLR4 в нейроцитах эмбриона (при участии белка-гистона H3K27me3) [1, 4, 5]. В период внутриутробного развития холин и его метаболит бетаин принимают участие в регуляции процессов метилирования ДНК эмбриона и плода, усиливая эффекты фолатов, цинка и витаминов В6 и В12 [6, 7].
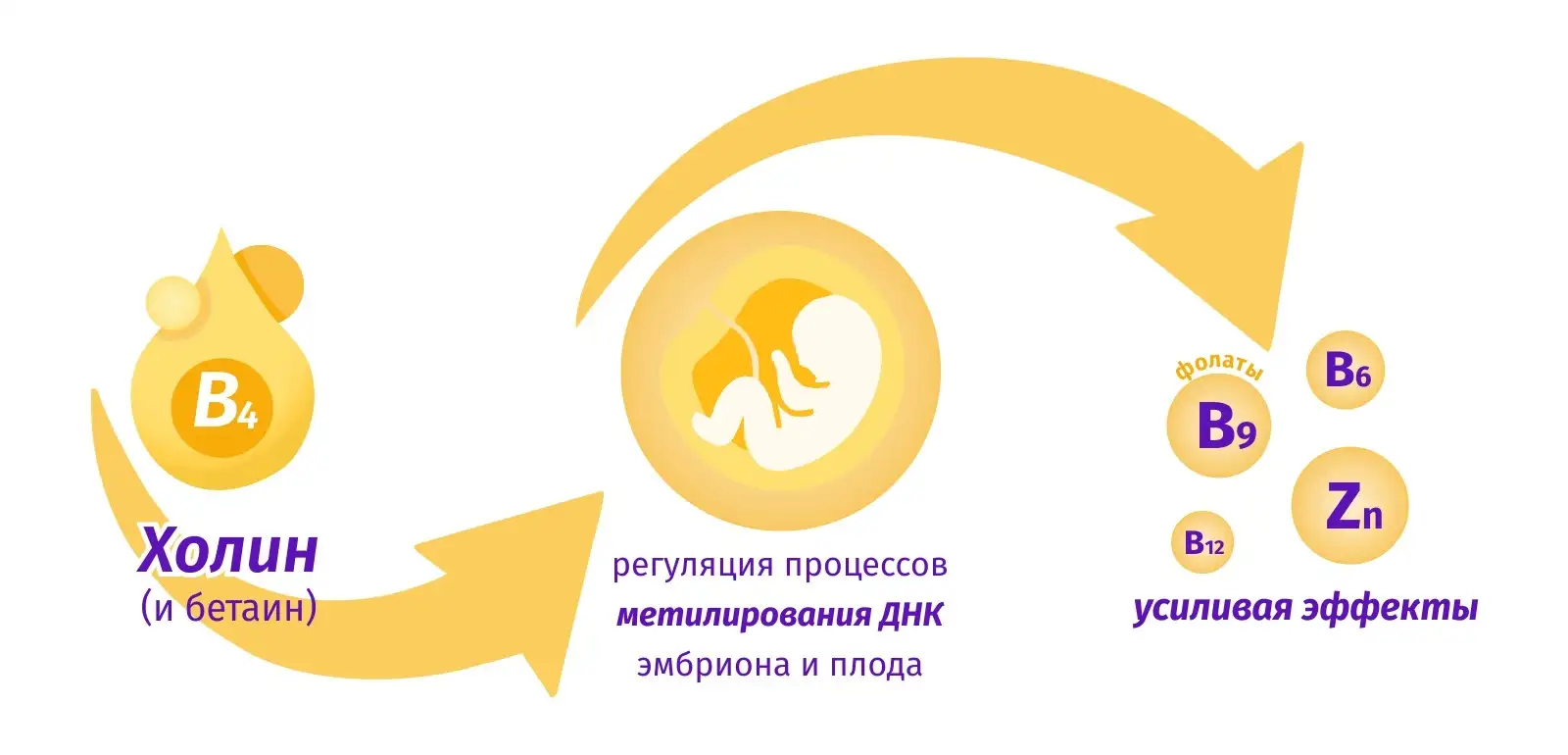
Фолаты транспортируются в клетки трофобласта через переносчик восстановленного фолата. Метионинсинтаза катализирует перенос метильной группы фолиевой кислоты (ФК) для реметилирования гомоцистеина в метионин, который затем используется для образования S-аденозилметионина. ДНК-метилтрансферазы катализируют перенос метильных групп от S-аденозилметионина к ДНК, обеспечивая естественный эпигенетический ландшафт метилирования ДНК и физиологический профиль экспрессии генов, включая факторы роста и матриксные металлопротеиназы, участвующие в процессах инвазии трофобласта. Наличие холина обеспечивает альтернативную донацию метильных групп в материнской печени даже при дефиците ФК, что обеспечивает дополнительный пул S-аденозилметионина и метионина для доставки в плаценту [6, 8].
Результаты проведенных исследований на беременных животных демонстрируют, что дефицит этих нутриентов в период беременности приводит к гипометилированию ДНК плода и новорожденного. Потомство, рожденное самками с недостаточным по содержанию доноров метильных групп питанием в период беременности, имели низкую массу тела, склонность к раннему ожирению и снижению продолжительности жизни по сравнению с группой, чей рацион был специально обогащен нутриентами, влияющими на метилирование ДНК [6, 9, 10].
Также одним из главных физических факторов, способствующих успешному зачатию, физиологичному вынашиванию беременности и рождению здоровых детей, является качество ооцитов. На качество ооцитов напрямую влияет окружающая среда с резко негативными факторами, в том числе неполноценное микронутриентое обеспечение женщины на этапе прегравидарной подготовки. Поддержка микронутриентного баланса – важнейший подход к оптимизации качества ооцитов. Холин, омега-3 ПНЖК, фолаты, лютеин и необходимы для повышения качества ооцитов. Холин играет важную роль в профилактике врожденных пороков развития, которые формируются на ранних стадиях деления ооцита, за счет влияния холина на структуру и функцию ооцитов. Обеспечение достаточного количества холина во время беременности важно для поддержки эпигенетических программ, что позволяет предотвратить аномалии развития и формирование хронических заболеваний у потомства [1, 6].

Плацента весьма чувствительна к недостаточному поступлению холина. Низкая обеспеченность холином на ранних сроках вызывает воспаление, нарушающее формирование сосудистой сети плаценты. Нутрицевтическая поддержка холином благотворно влияет на ее функции, включая ангиогенез, воспаление и транспорт макронутриентов [1, 11].
Сравнение потребления холина показало, что более высокое потребление беременными нормализует экспрессию генов, регулирующих плацентарную васкуляризацию, ангиогенез, снижая, в частности, экспрессию антиангиогенного фактора Fms-подобная тирозинкиназа-1 (фактор риска преэклампсии). Более высокая доза холина также способствовала снижению уровней кортизола в плазме крови новорожденных (что важно для снижения риска заболеваний, связанных со стрессом, в более старшем возрасте ребенка) [1, 12, 13].
Дефицит холина и фолатов в клетках трофобласта линии HTR-8/SVneo нарушает регуляцию уровней белков, участвующих в васкуляризации не только плаценты, но и других тканей [1, 14].
Дисфункция сосудов в системе плаценты отрицательно сказывается на темпах роста плода. Низкий уровень холина в плазме крови беременных связан с высокими шансами рождения детей с задержкой развития плода. Холин оказывает защитное действие против вызванных гипоксией повреждений эндотелия сосудов [1, 15, 16].

Концентрация холина в амниотической жидкости в 10 раз выше, чем в крови матери, что приводит к 6-кратному повышению содержания холина в тканях плода. Как и фолаты, холин важен для предотвращения ДНТ, поскольку он необходим для закрытия нервной трубки и превращения гомоцистеина в метионин. Дефицит холина снижает концентрацию S-аденозилметионина – основного субстрата для метилирования ДНК. В результате в нейронах человека дефицит холина снижает метилирование промотора гена CDKN3, что приводит к сверхэкспрессии этого гена и к торможению деления нейронов [1, 17, 18, 19, 20, 21].
Холин необходим для развития гиппокампа и связан с развитием нервных путей и экспрессией генов, участвующих в процессах памяти. Важность холина для поддержания адекватного развития нервной системы плода обусловлена не только поддержкой метилирования ДНК, но и тесной взаимосвязью биологических ролей холина с реализацией эффектов нейротрофических факторов [1, 22, 23].

Дотации холина тормозят тератогенез, провоцируемый дибутилфталатом. Данный тератоген – стойкий загрязнитель окружающей среды, вызывающий аномальное развитие нервной трубки плода. При дефиците холина также увеличивался апоптоз нейронов в гиппокампе по сравнению с результатами, полученными при дотациях холина [1, 24, 25].
Проведенные клинические исследования показали, что высокое потребление холина в перинатальный период оказывает значимое нейропротекторное действие на головной мозг плода и в последующем улучшает когнитивные способности ребенка. Более высокое потребление холина матерями улучшало скорость обработки информации у младенцев в возрасте 4, 7, 10 и 13 мес. Даже умеренное пренатальное потребление добавок холина (300–350 мг/сут) в контексте полноценного питания может оказывать положительное влияние на когнитивную функцию. Последующее исследование выявило долгосрочные преимущества более высокого материнского потребления холина для ребенка с точки зрения формирования внимания, памяти и способности к решению задач. Иначе говоря, более высокое потребление холина матерью во время беременности дает преимущества в развитии умственных способностей в школьном возрасте. В частности, потребление холина в пределах рекомендуемого для беременных было связано с лучшей функцией памяти у детей 7-летнего возраста по сравнению с детьми от матерей, потреблявших менее 50% рекомендуемого [1, 26, 27, 28].
Низкая обеспеченность холином нарушает развитие и функцию сетчатки плода, так как приводит к стойким дефектам цитоархитектоники сетчатки (начиная от очаговых поражений со смещением нейронов сетчатки в субретинальное пространство и заканчивая выраженной гипоклеточностью и ультраструктурными дефектами в организации фоторецепторов). Дефицит холина также нарушает своевременную дифференцировку нейронов сетчатки, так что снижается плотность ее ганглиозных клеток, амакриновых и горизонтальных клеток, а также клеток-предшественников колбочковых фоторецепторов [1, 29].
Холин и другие витамины группы B взаимосвязаны с заболеваемостью и тяжестью течения расстройств аутистического спектра. По сравнению со здоровыми детьми у детей с РАС определен низкий уровень холина и других витаминов группы В [1, 30].

Холин играет важную роль в планировании беременности и во время самой беременности, влияя на три основных аспекта: эпигенетическое программирование, функцию плаценты и врожденные пороки развития. Исследования показывают, что достаточное потребление холина может оказать положительное воздействие на здоровье будущего ребенка и на ход беременности в целом. Понимание механизмов действия холина на эти процессы может помочь разработать более эффективные стратегии поддержки здоровья матери и ребенка.
Перспективным направлением в нутрициальной поддержке беременности является прием холина в сочетании с другими микронутриентами. Препарат Фемибион® I содержит холин, фолаты и другие витамины группы В, которые необходимы для задорого течения беременности и правильного формирования плода*.
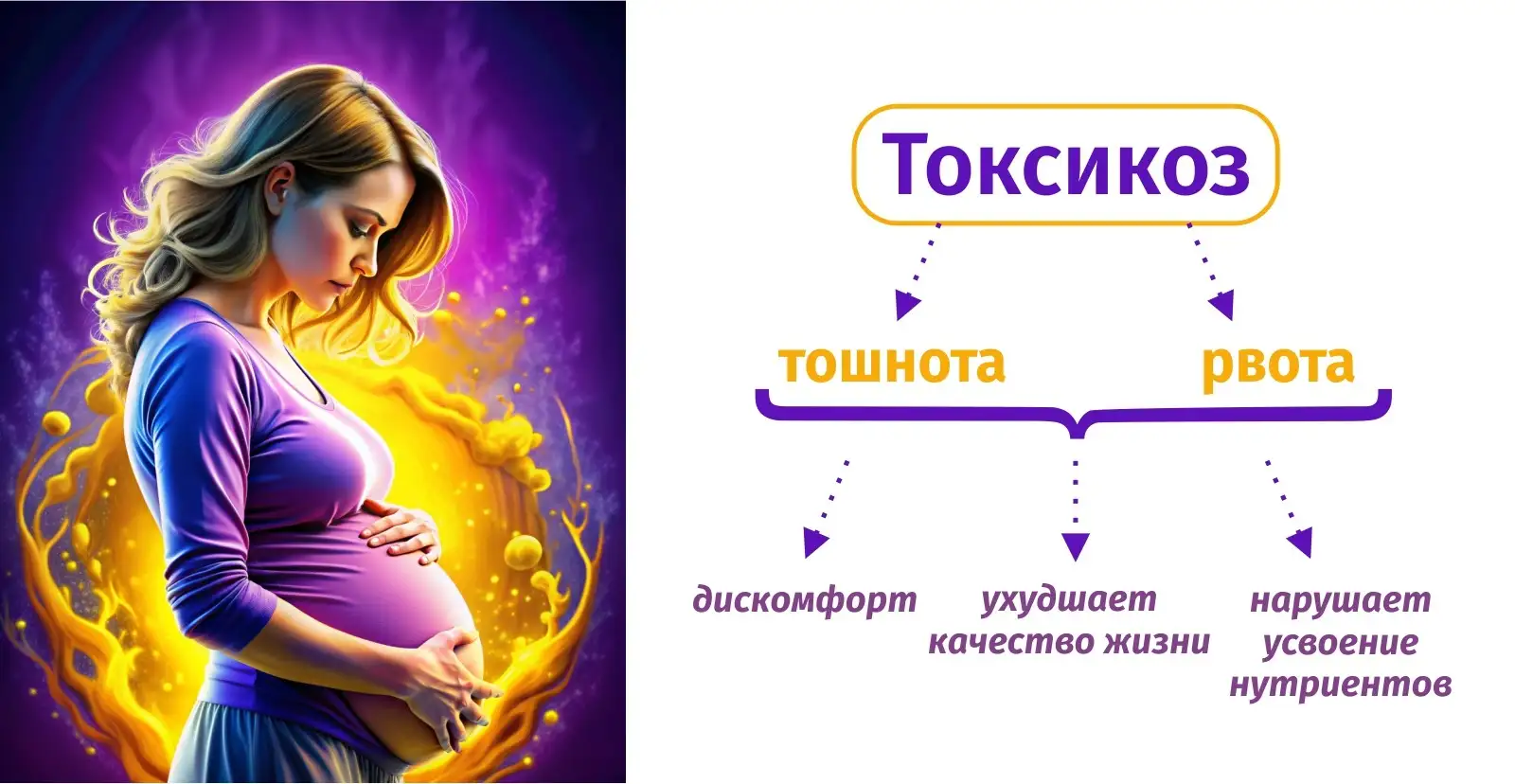
Также во время беременности женщины часто сталкиваются с токсикозом, который проявляется тошнотой и рвотой, что, как правило, вызывает дискомфорт, ухудшает качество жизни, и что самое важное – может нарушать усвоение необходимых нутриентов для здоровья женщины и плода.

Контроль токсикоза и предотвращение рвоты играют важную роль в усвоении холина и других нутриентов. Токсикоз, характерный для беременных женщин, может существенно осложнить процесс усвоения питательных веществ. Рвота, являющаяся частым симптомом токсикоза, может привести к потере ценных витаминов, минералов и других важных компонентов питания.
Так, комплекс Прегинор®, содержащий экстракт имбиря, витамин В6, магний помогает контролировать токсикоз во время беременности**. Гингерол и его производные, входящие в состав экстракта имбиря, действуют сразу на два пути развития тошноты и рвоты – центральный и периферический. Витамин В6 и магний участвуют во многих метаболических процессах и их регуляции, поэтому они необходимы для обеспечения нормального самочувствия.
* – С более подробной информацией о витаминных комплексах Фемибион® Вы можете ознакомиться на сайте https://femibion.ru/.
** – С более подробной информацией о комплексе Прегинор® Вы можете ознакомиться на сайте https://preginor.ru/.
Список литературы:
1. Громова О. А., Торшин И. Ю., Тетруашвили Н. К. Новые подходы к нутрициальному сопровождению беременности: фокус на холин //Акушерство и гинекология: Новости. Мнения. Обучения. – 2023. – Т. 11. – №. 4 (42). – С. 60-75.
2. Громова О.А., Рудаков К.В., Торшин И.Ю. Систематический анализ эффектов холина на нервную систему на основе биохимических маршрутов. Анализ независимой литературы по молекулярной фармакологии и клиническимисследованиям // Трудный пациент. 2009. Т. 7, № 4–5. С. 13–18.
3. Chmurzynska A., Seremak-Mrozikiewicz A., Malinowska A.M., Różycka A., Radziejewska A., KurzawiŃska G. et al. Associations between folate and choline intake, homocysteine metabolism, and genetic polymorphism of MTHFR, BHMT and PEMT in healthy pregnant Polish women // Nutr. Diet. 2020. Vol. 77, N 3. P. 368–372. DOI: https://doi.org/10.1111/1747-0080.12549 Epub 2019 May 1. PMID: 31044529.
4. Торшин И.Ю., Громова О.А., Стаховская Л.В., Семенов В.А., Щукин И.А. Хемотранскриптомный анализ указывает на нейротрофические и нейромодулирующие эффекты молекулы цитиколина // Неврология, нейропсихиатрия, психосоматика. 2020. Т. 12, № 4. С. 91–99. DOI: https://doi.org/10.14412/2074-2711-2020-4-91-99.
5. Guan X., Chen X., Dai L., Ma J., Zhang Q., Qu S. et al. Low maternal dietary intake of choline regulates toll-like receptor 4 expression via histone H3K27me3 in fetal mouse neural progenitor cells // Mol. Nutr. Food Res. 2021. Vol. 65, N 2. Article ID e2000769. DOI: https://doi.org/10.1002/mnfr.202000769 Epub 2020 Dec 13. PMID: 33274576.
6. Тапильская Н.И., Жернакова Т.С., Беспалова О.Н., Рыжов Ю.Р., Глушаков Р.И. Роль холина в эпигенетическом программировании соматического и психического здоровья в момент внутриутробного развития плода и предотвращении акушерских осложнений // Фарматека. - 2023. - Т. 30. - №4/5. - C. 16-22. doi: 10.18565/pharmateca.2023.4-5.16-22.
7. Imbard A., Benoist J.F., Blom H.J. Neural tube defects, folic acid and methylation. Int J Environ Res Public Health. 2013;10(9):4352–89. Doi: 10.3390/ijerph10094352.
8. Clare C.E., Brassington A.H., Kwong W.Y., Sinclair K.D. One-Carbon Metabolism: Linking Nutritional Biochemistry to Epigenetic Programming of Long-Term Development. Annu Rev Anim Biosci. 2019;7:263–87. Doi: 10.1146/annurev-animal-020518-115206.
9. Ding Y., Li J., Liu S., et al. DNA hypomethylation of inflammation-associated genes in adipose tissue of female mice after multigenerational high fat diet feeding. Int J Obes (Lond). 2014;38(2):198–204. Doi: 10.1038/ijo.2013.98.
10. Liu H.Y., Liu S.M., Zhang Y.Z. Maternal Folic Acid Supplementation Mediates Offspring Health via DNA Methylation. Reprod Sci. 2020;27(4):963–76. Doi: 10.1007/s43032-020-00161-2.
11. Korsmo H.W., Jiang X., Caudill M.A. Choline: exploring the growing science on its benefi ts for moms and babies // Nutrients. 2019. Vol. 11, N 8. P. 1823. DOI: https://doi.org/10.3390/nu11081823 PMID: 31394787.
12. Jiang X., Yan J., West A.A., Perry C.A., Malysheva O.V., Devapatla S. et al. Maternal choline intake alters the epigenetic state of fetal cortisol-regulating genes in humans // FASEB J. 2012. Vol. 26, N 8. P. 3563–3574. DOI: https://doi.org/10.1096/fj.12-207894 Epub 2012 May 1. PMID: 22549509.
13. Jiang X., Jones S., Andrew B.Y., Ganti A., Malysheva O.V., Giallourou N. et al. Choline inadequacy impairs trophoblast function and vascularization in cultured human placental trophoblasts // J. Cell. Physiol. 2014. Vol. 229, N 8. P. 1016–1027. DOI: https://doi.org/10.1002/jcp.24526 PMID: 24647919.
14. Engelhart K., Pfi tzner I., Obeid R. An exploratory study on the effect of choline and folate defi ciency on levels of vascularization proteins and transcription factors in fi rst trimester trophoblast HTR-8/SVneo cells // J. Obstet. Gynaecol. Res. 2023. Vol. 49, N 4. P. 1114–1120. DOI: https://doi.org/10.1111/jog.15555 Epub 2023 Jan 15. PMID: 36642422.
15. Hoffman M.C., Hunter S.J., D’Alessandro A., Christians U., Law A.J., Freedman R. Maternal plasma choline during gestation and small for gestational age infants // Am. J. Perinatol. 2022; Dec 30. DOI: https://doi.org/10.1055/s-0042-1759775 PMID: 36584689.
16. Zhang L.C., Jin X., Huang Z., Yan Z.N., Li P.B., Duan R.F. et al. Protective effects of choline against hypoxia-induced injuries of vessels and endothelial cells // Exp. Ther. Med. 2017. Vol. 13, N 5. P. 2316–2324. DOI: https://doi.org/10.3892/etm.2017.4276 PMID: 28565844.
17. Molloy A.M., Mills J.L., Cox C., Daly S.F., Conley M. et al. Choline and homocysteine interrelations in umbilical cord and maternal plasma at delivery // Am. J. Clin. Nutr. 2005. Vol. 82, N 4. P. 836–842. DOI: https://doi.org/10.1093/ajcn/82.4.836 PMID: 16210714.
18. Nyaradi A., Li J., Hickling S., Foster J., Oddy W.H. The role of nutrition in children’s neurocognitive development, from pregnancy through childhood // Front. Hum. Neurosci. 2013. Vol. 7. P. 97. DOI: https://doi.org/10.3389/fnhum.2013.00097 PMID: 23532379; PMCID: PMC3607807.
19. Zeisel S.H. Choline: critical role during fetal development and dietary requirements in adults // Annu. Rev. Nutr. 2006. Vol. 26. P. 229–250. DOI: https://doi.org/10.1146/ annurev.nutr.26.061505.111156 PMID: 16848706; PMCID: PMC2441939.
20. Shivapurkar N., Poirier L.A. Tissue levels of S-adenosylmethionine and S-adenosylhomocysteine in rats fed methyl-defi cient, amino acid-defi ned diets for one to fi ve weeks // Carcinogenesis. 1983. Vol. 4. P. 1051–1057. PMID: 6872150.
21. Niculescu M.D., Yamamuro Y., Zeisel S.H. Choline availability modulates human neuroblastoma cell proliferation and alters the methylation of the promoter region of the cyclin-dependent kinase inhibitor 3 gene // J. Neurochem. 2004. Vol. 89. P. 1252–1259. PMID: 15147518.
22. Blusztajn J.K., Slack B.E., Mellott T.J. Neuroprotective actions of dietary choline // Nutrients. 2017. Vol. 9, N 8. P. 815. DOI: https://doi.org/10.3390/nu9080815 PMID: 28788094; PMCID: PMC5579609.
23. Johansson J., Formaggio E., Fumagalli G., Chiamulera C. Choline up-regulates BDNF and down-regulates TrkB neurotrophin receptor in rat cortical cell culture // Neuroreport. 2009. Vol. 20, N 9. P. 828–832. DOI: https://doi.org/10.1097/ WNR.0b013e32832b7324 PMID: 19424097.
24. Wang R., Sun D.G., Song G., Guan C.Y., Cui Y., Ma X. et al. Choline, not folate, can attenuate the teratogenic effects ofdibutyl phthalate (DBP) during early chick embryo development // Environ. Sci. Pollut. Res. Int. 2019. Vol. 26, N 29. P. 29 763–29 779. DOI: https://doi.org/10.1007/s11356-019-06087-w Epub 2019 Aug 12. PMID: 31407264.
25. Craciunescu C.N., Albright C.D., Mar M.H., Song J., Zeisel S.H. Choline availability during embryonic development alters progenitor cell mitosis in developing mouse hippocampus // J. Nutr. 2003. Vol. 133, N 11. P. 3614–3618. DOI: https://doi.org/10.1093/jn/133.11.3614 PMID: 14608083.
26. Caudill M.A., Strupp B.J., Muscalu L., Nevins J.E.H., Canfi eld R.L. Maternal choline supplementation during the third trimester of pregnancy improves infant information processing speed: a randomized, double-blind, controlled feeding study // FASEB J. 2018. Vol. 32, N 4. P. 2172–2180. DOI: https://doi.org/10.1096/fj.201700692RR Epub 2018 Jan 5. PMID: 29217669; PMCID: PMC6988845.
27. Nevins J.E.H., Beckman K.A., Bahnfl eth C.L., Drewes B.M., Caudill M.A., Strupp B.J. et al. Maternal choline supplementation during pregnancy improves executive functioning in children at age 7 y // Presented at: American Society for Nutrition Annual Meeting. Boston, MA, June 9–12, 2018.
28. Boeke C.E., Gillman M.W., Hughes M.D., Rifas-Shiman S.L., Villamor E., Oken E. Choline intake during pregnancy and child cognition at age 7 years // Am. J. Epidemiol. 2013. Vol. 177, N 12. P. 1338–1347. DOI: https://doi.org/10.1093/aje/kws395. Epub 2013 Feb 20. PMID: 23425631; PMCID: PMC3676149.
29. Trujillo-Gonzalez I., Friday W.B., Munson C.A., Bachleda A., Weiss E.R., Alam N.M. et al. Low availability of choline in utero disrupts development and function of the retina // FASEB J. 2019. Vol. 33, N 8. P. 9194–9209. DOI: https://doi.org/10.1096/fj.201900444R Epub 2019 May 15. PMID: 31091977.
30. Jennings L., Basiri R. Amino acids, B vitamins, and choline may independently and collaboratively infl uence the incidence and core symptoms of autism spectrum disorder // Nutrients. 2022. Vol. 14, N 14. P. 2896. DOI: https://doi.org/10.3390/nu14142896 PMID: 35889852.
Три основных направления работы холина при планировании беременности и во время самой беременности.
Комментарии (0)